Введение
Сахарный диабет 2 типа (СД2) – это системное заболевание обмена веществ, принявшее пандемический характер распространения, что побудило Организацию Объединенных Наций в декабре 2006 г. принять резолюцию, призывающую «создавать национальные программы по предупреждению, лечению и профилактике СД и его осложнений и включать их в состав государственных программ по здравоохранению» [1].
По данным Государственного регистра больных СД на январь 2011 г., в Российской Федерации по обращаемости в лечебные учреждения насчитываются 3,357 млн больных СД. Между тем результаты контрольно-эпидемиологических исследований, проведенных ФГБУ «Эндокринологический научный центр» с 2002 по 2010 г. показали, что приблизительно еще у 6 млн россиян имеется СД, но они не знают об этом и, следовательно, не получают лечения [1].
Распространенность артериальной гипертензии (АГ) в популяции в настоящее время сохраняется на высоком уровне без тенденции к ее снижению и составляет 30–45 % в Европе [2] и около 40 % – в Российской Федерации [3, 4].
СД и АГ – две взаимосвязанные патологии, обладающие мощным взаимоусиливающим повреждающим действием, направленным сразу на несколько органов-мишеней: сердце, почки, сосуды [5]. Более чем у 70–80 % пациентов с СД2 имеется АГ [6]. Сочетание СД2 и АГ несет угрозу преждевременной инвалидизации и смерти от сердечно-сосудистых осложнений [6]. Так, по данным Фремингемского исследования, АГ в 5 раз увеличивает смертность среди больных СД [7]. При СД2 без сопутствующей АГ риск развития ишемической болезни сердца и инсульта повышается в 2–3 раза, почечной недостаточности – в 15–20, полной потери зрения – в 10–20, гангрены – в 20 раз. При присоединении к СД АГ риск этих осложнений возрастает еще в 2–3 раза – даже при удовлетворительном контроле метаболических нарушений [5].
При СД2 развитие АГ в 50–70 % случаев предшествует нарушению углеводного обмена [5]. Как правило, такие больные имеют избыточную массу тела, нарушения липидного обмена, позже у них появляются признаки нарушенной толерантности к углеводам, которые у 40 % пациентов преобразуются затем в развернутую картину СД2. В 1988 г.
G. Reaven предположил, что в основе развития всех перечисленных нарушений (АГ, дислипидемии, ожирения, нарушенной толерантности к углеводам) лежит единый патогенетический механизм — нечувствительность периферических тканей (мышечной, жировой, клеток эндотелия) к действию инсулина. Инсулинорезистентность (ИР) приводит к развитию компенсаторной гиперинсулинемии, долгое время способной поддерживать нормальный углеводный обмен. Гиперинсулинемия в свою очередь запускает каскад патологических механизмов, ведущих к развитию АГ, дислипидемии и ожирению [5].
Гиперинсулинемия обеспечивает повышение уровня артериального давления (АД) посредством нескольких механизмов [6]:
- Инсулин повышает активность симпатоадреналовой системы.
- Инсулин повышает реабсорбцию натрия и жидкости в проксимальных канальцах почек.
- Инсулин как митогенный фактор усиливает пролиферацию гладкомышечных клеток сосудов, что сужает их просвет.
- Инсулин блокирует активность Na-K-АТФазы и Ca-Mg-АТФазы, тем самым увеличивая внутриклеточное содержание Na+ и Са++ и повышая чувствительность сосудов к воздействию вазоконстрикторов.
Таким образом, АГ при СД2 служит частью общего симптомокомплекса, в основе которого лежит ИР.
Почему же столь стремительно развивается патология органов-мишеней при одновременном сосуществовании СД и АГ? Причина заключается в том, что первым слоем клеток, берущих на себя как метаболический, так и гидравлический «удар», является слой клеток эндотелия сосудов [8]. Эндотелий, подвергаясь длительному воздействию гипергликемии и дислипидемии, характерных для СД2, а также механическому давлению изнутри вследствие высокого АД, постепенно «выходит из строя». Происходит прогрессирование эндотелиальной дисфункции (ЭД): нарушается биодоступность оксида азота (NO) за счет уменьшения его образования и усиленного разрушения, снижения плотности мускариноподобных рецепторов, активация которых приводит к синтезу NO, повышению активности ангиотензинпревращающего фермента на поверхности эндотелиальных клеток, катализирующего превращение ангиотензина I в ангиотензин II, а также к выработке эндотелина-1 (ЭТ-1) и других вазоконстрикторных субстанций [5, 9].

Первичная цель лечения больных АГ и СД2 заключается в максимальном снижении показателя общего долгосрочного риска сердечно-сосудистой патологии. Для этого необходима коррекция всех обратимых факторов риска (гипергликемии, дислипидемии), сопутствующих клинических состояний и повышенного АД как такового (класс рекомендаций I, уровень доказательности А). Поэтому особенностью ведения пациентов с АГ и СД2 является тщательный контроль уровней глюкозы и липидов в крови, а также АГ.
- К немедикаментозным методам снижения АД относят [1]:
- ограничение употребления поваренной соли до 3 г/сут;
- снижение массы тела (при индексе массы тела – [ИМТ] > 25 кг/м2);
- употребление алкоголя не более 30 г/сут для мужчин и 15 г/сут для женщин;
- отказ от курения;
- аэробные физические нагрузки по 30–40 минут 3–4 раза в неделю.
Если при соблюдении вышеуказанных немедикаментозных методов лечения АГ уровень АД стабильно превышает целевые значения – 140/85 мм рт. ст. [2], необходимо начинать прием антигипертензивных препаратов. Концепция более низких целевых уровней АД для пациентов с СД не нашла своего подтверждения в клинических исследованиях [10]. Наоборот, уменьшение систолического АД (САД) ниже 120–125 мм рт. ст. и диастолического АД (ДАД) ниже 70–75 мм рт. ст. сопровождалось повышением частоты сердечно-сосудистых событий [11].
Так как пациенты с СД2 относятся к группе высокого или очень высокого риска по развитию сердечно-сосудистых осложнений в зависимости от наличия факторов риска и поражения органов-мишеней (класс рекомендаций IIа, уровень доказательности С), им рекомендована комбинированная антигипертензивная терапия [10].
Выбор антигипертензивного препарата при СД
Все классы антигипертензивных препаратов рекомендованы и могут быть использованы пациентами с СД (класс рекомендаций I, уровень доказательности А) [12]. При выборе антигипертензивной терапии больных СД необходимо учитывать спектр его побочных эффектов, прежде всего воздействие на углеводный и липидный обмены.
Блокаторы ренин-ангиотензин-альдостероновой системы (РААС) – ингибиторы ангиотензинпревращающего фермента (ИАПФ) или антагонисты рецепторов ангиотензина II (АРА II), более предпочтительны, особенно при наличии протеинурии или микроальбуминурии (МАУ) – класс рекомендаций I, уровень доказательности А [12]. ИАПФ и АРА II не оказывают негативного воздействия на углеводный и липидный обмены, снижают ИР периферических тканей [1]. Доказана их профилактическая роль в отношении развития СД2 [1].
Диуретики. Тиазидные диуретики в малых дозах (< 12,5 мг/сут) не вызывают значимых метаболических нарушений (гипергликемии, дислипидемии, гипокалиемии), поэтому их применение безопасно для больных СД [1]. Больным с риском развития СД предпочтительна более низкая доза тиазида (< 6,25 мг/сут) [1]. Тиазидные диуретики в высоких дозах (50 мг гидрохлоротиазида или эквивалентные дозы других диуретиков) повышают уровень глюкозы натощак и концентрацию гликированного гемоглобина (HbA1c), а также нарушают толерантность к пероральной и внутривенной нагрузке глюкозой за счет уменьшения секреции инсулина и ИР.
Кроме того, использование тиазидных диуретиков способно увеличить риск возникновения СД у лиц пожилого и старческого возраста [5]. У больных с СД2 для лечения АГ более эффективны комбинации малых доз тиазидных или тиазидоподобных диуретиков с ИАПФ/АРА II [2].
Бета-адреноблокаторы (БАБ) способны маскировать развитие гипогликемии и затруднять выход из гипогликемического состояния [1]. Эти препараты следует с осторожностью назначать больным СД с нарушенным распознаванием гипогликемии. Неселективные БАБ, не имеющие сосудорасширяющей активности (пропранолол), повышают риск развития СД2 вследствие усиления периферической ИР и дислипидемии, поэтому их следует избегать при лечении больных СД и групп риска развития СД2 [1]. Селективные БАБ в меньшей степени оказывают негативные метаболические эффекты, а БАБ с сосудорасширяющей активностью (карведилол, небиволол) способны улучшать показатели углеводного и липидного обменов и повышать чувствительность тканей к инсулину [1].
Антагонисты кальция (АК) в средних терапевтических дозах метаболически нейтральны, т. е. не влияют на углеводный и липидный обмены и не повышают риска развития СД2 [1].
В отношении больных СД2 для лечения АГ эффективны комбинации АК с ИАПФ/АРА II [2].
Следует отметить, что из дополнительных групп антигипертензивных средств лечения АГ больным СД2 могут быть рекомендованы препараты центрального действия группы агонистов I1-имидазолиновых рецепторов (моксонидин, рилменидин) в составе комбинированной антигипертензивной терапии, т. к. они обладают благоприятным метаболическим профилем: снижают ИР, гипергликемию, нейтральны по отношению к липидному обмену [1]. Больным АГ и СД2 не рекомендуется назначать два блокатора РААС (класс рекомендаций III, уровень доказательности B) [2].
Так как для пациентов с СД2 характерно повышение АД в ночные часы, прием антигипертензивных препаратов перед сном предпочтителен – особенно после определения суточного профиля АД [2]. Это также может быть связано с повышенной активностью РААС в ночное время у этих больных.
Комбинация двух антигипертензивных препаратов в фиксированных дозировках в одной таблетке может быть рекомендована и предпочтительна, т. к. снижает количество употребляемых таблеток [2].
Таким образом, патофизиологическая роль АГ в столь значимом повышении риска сердечно-сосудистых осложнений у больных СД2 остается до конца не изученной проблемой и актуальна для научных дискуссий во всем мире. В настоящее время считается, что в патогенезе ангиопатий при СД и АГ инициирующую роль в нарушении тонуса и развитии последующих атеросклеротических изменений сосудов принадлежит дисфункции эндотелия. В то же время на сегодняшний день недостаточно полно изучены сочетанные поражения сосудистого и плазменного компонентов эндотелия у больных АГ с СД2, практически не изучены органные поражения эндотелия у больных АГ с СД2, практически нет данных о корреляционных связях между ИР, эндотелиальной функцией и поражением органов-мишеней у больных АГ с СД2, а также мало сведений по влиянию комбинаций антигипертензивных препаратов на эндотелий. Поэтому нами было проведено проспективное контролируемое исследование с применением фиксированной комбинации амлодипина и лизиноприла (Экватор) больными АГ и СД2.
Целью исследования была оценка влияния комбинированной антигипертензивной терапии Экватором на ИР и ЭД на больных АГ и СД2.
Материал и методы
В исследование были включены 30 больных АГ II–III стадий по классификации Всероссийского научного общества кардиологов 2008 г. [3] и СД2 в возрасте от 40 до 65 лет. Клинико-демографическая характеристика больных представлена в табл. 1.
За 5–7 дней до включения в исследование больным отменили антигипертензивные препараты («отмывочный период»). Всем пациентам была назначена комбинированная антигипертензивная терапия амлодипином 6,0 ± 0,4 мг/сут и лизиноприлом 12,0 ± 0,9 мг/сут (Экватор, Гедеон Рихтер; Венгрия) в течение 12 недель. Эндотелиальную функцию изучали по концентрации NO в сыворотке крови и в моче; уровню ЭТ-1 в сыворотке крови и в моче. Сосудистый компонент эндотелиальной функции оценивали после проведения окклюзионной пробы в течение 3 минут с использованием метода лазерной допплеровской флоуметрии (ЛДФ), микроциркуляции крови на аппарате ЛАКК-ОП (НПО «Лазма», Россия). Всем больным проведено суточное мониторирование артериального давления (СМАД), эхокардиографическое исследование, анализированы эластические свойства артерий по общепринятым методикам [9]. Функциональное состояние почек оценено путем определения экскреции альбумина с мочой (МАУ) по соотношению альбумин/креатинин в утренней порции мочи, уровня ß2-микроглобулинов в моче, креатинина крови с расчетом клиренса креатинина (КК) по формуле Кокрафта–Гаулта, скорости клубочковой фильтрации (СКФ) по формулам MDRD (Modification Diet Renal Disease) и CKD-EPI (Chronic Kidney Desease Epidemiology Collaboration).
О состоянии углеводного обмена судили по концентрации глюкозы крови натощак, уровням HbA1c и базального инсулина с расчетом индекса HOMA (Homeostasis Model Assessment for Insulin Resistance) [13].
Обработка результатов исследования проведена методами параметрической и непараметрической статистики. Использован пакет статистических программ «Microsoft Excel 2003». Данные представлены в виде M ± m, где M – среднее значение, m – ошибка среднего. Достоверными считались различия при p < 0,05.
Результаты и обсуждение
На фоне 12-недельной терапии Экватором отмечен высокий процент достижения целевых значений АД – 93,3 %. Уровень офисного САД снизился на 21,0 % (p < 0,05), а офисного ДАД – на 13,5 % (p < 0,05), табл. 1.
Через 12 недель комбинированной антигипертензивной терапии выявлено достоверное улучшение эндотелиальной функции у больных АГ и СД2: статистически значимо увеличилась продукция NO как в сыворотке крови, так и в моче: 12,7 ± 1,5 исходно против 19,5 ± 2,2 мкМ на фоне лечения, ∆% = 53,5; 428,2 ± 27,9 исходно против 672,7 ± 55,3 мкМ на фоне лечения, ∆% = 57,1 соответственно. Закономерно уменьшилась секреция ЭТ-1 и в сыворотке крови, и в моче: 2,49 ± 0,01 исходно против 1,8 ± 0,1 пг/мл на фоне лечения, ∆% = -27,7; 0,46 ± 0,04 исходно против 0,14 ± 0,004 пг/мл на фоне лечения, ∆% = -69,6 соответственно; p < 0,05 (табл. 2).
При анализе сосудистого компонента эндотелиальной функции на фоне лечения Экватором достоверно увеличился процент больных с нормоциркуляторным типом микроциркуляции: с 13,3 исходно до 73,3 % через 12 недель терапии (p < 0,001) за счет уменьшения процента больных с гиперемическим и спастическим типами микроциркуляции (табл. 2). Статистически значимое снижение резерва капиллярного кровотока обусловлено переходом больных с исходно спастическим типом микроциркуляции в нормоциркуляторный, что отражает уменьшение активности симпатической нервной системы при терапии Экватором.
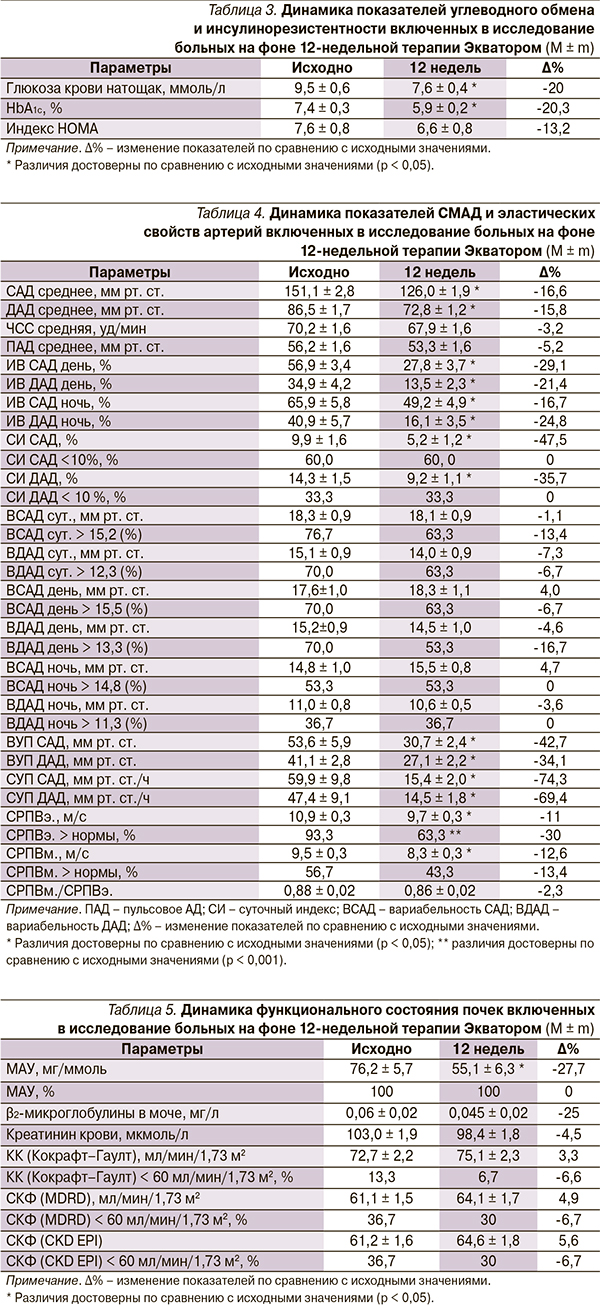
При анализе состояния углеводного обмена (табл. 3) статистически значимо уменьшились концентрация глюкозы крови натощак (9,5 ± 0,6 исходно против 7,6 ± 0,4 ммоль/л через 12 недель лечения, ∆% = -20) и уровень HbA1c: с 7,4 ± 0,3 до 5,9 ± 0,2 % (∆% = -20,3). Комбинированная терапия Экватором привела к снижению ИР у больных АГ СД2 – индекс HOMA уменьшился с 7,6 ± 0,8 до 6,6 ± 0,8 (∆% = -13,2). Установлены статистически значимые корреляции средней силы между индексом HOMA и концентрацией NO в моче (r = -0,45), NO в крови (r = -0,54), ЭТ-1 в крови (r = -0,54) соответственно.
При обработке результатов СМАД (табл. 4) выявлены достоверные изменения САДсреднее, ДАДсреднее, индекса времени (ИВ) САДдень, ночь, ИВ ДАДдень, ночь, величины утреннего подъема (ВУП) САД, ВУП ДАД, скорости утреннего подъема (СУП) САД и СУП ДАД (∆% = -16,6; -15,8; -29,1; -16,7; -21,4; -24,8; -42,7; -34,1; -74,3; -69,4 соответственно). Выявлены тесные корреляционные связи между индексом HOMA и САДсреднее (r = 0,21; p < 0,05), ЭТ-1 в моче и САДсреднее (r = 0,7; p < 0,05), ЭТ-1 в моче и ДАДсреднее (r = 0,99; p < 0,05), ЭТ-1 в крови и ДАДсреднее (r = 0,88; p < 0,05).
При анализе структурно-функциональных параметров сердца отмечено уменьшение толщины задней стенки левого желудочка на 4,5 % (p < 0,05), а также индекса массы миокарда левого желудочка (ИММЛЖ) на 10,7 % (p < 0,05). Определены корреляционные зависимости между ЭТ-1 в крови и фракцией выброса ЛЖ (r = -0,53; p < 0,05), ЭТ-1 в крови и ИММЛЖ (r = 0,82; p < 0,05), NO в крови и ИММЛЖ (r = -0,43; p < 0,05), NO в моче и ИММЛЖ (r = -0,49; p < 0,05).
При анализе эластичности сосудистой стенки выявлено достоверное снижение скорости распространения пульсовой волны по сосудам эластического типа (СРПВэ.) на 11 % и по сосудам мышечного типа (СРПВм.) – на 12,6 %, а также статистически значимое уменьшение числа больных с СРПВэ. выше нормы на 30 % (табл. 4).
Установлены статистически значимые корреляции средней силы между индексом HOMA и СРПВэ. (r = 0,61), ЭТ-1 в моче и СРПВэ. (r = 0,94).
При оценке функционального состояния почек отмечено снижение уровня МАУ на 27,7 % (p < 0,05), табл. 5.
Определены достоверные корреляционные зависимости между индексом HOMA и СКФ MDRD и СКФ CKD-EPI (r = -0,66 и r = -0,63 соответственно), NO в крови и МАУ (r = -0,38), ЭТ-1 в крови и МАУ (r = 0,37), ЭТ-1 в моче и СКФ (r = -0,99), NO в крови и СКФ (r = 0,68).
Заключение
Исследование подтверждает наличие тесных корреляционных взаимоотношений между ИР, ЭД и поражением органов-мишеней. Уменьшение степени выраженности ИР и ЭД на фоне комбинированной терапии амлодипином и лизиноприлом в течение 12 недель приводит к улучшению состояния органов-мишеней: сердца, почек, сосудов. Отмечено достоверное улучшение параметров СМАД, уменьшение ИММЛЖ, тенденция к улучшению диастолической функции левого желудочка и повышению СКФ, снизился уровень МАУ, уменьшилось число больных с повышенной СРПВэ., что свидетельствует о возможности замедления прогрессирования АГ и СД2 на фоне терапии Экватором.
Таким образом, применение фиксированной комбинации амлодипина и лизиноприла (Экватор) в течение 12 недель является патогенетически обоснованным, высокоэффективным и безопасным методом лечения больных АГ и СД2.


