По данным эпидемиологических исследований, распространенность артериальной гипертензии (АГ) среди взрослого населения в развитых странах мира колеблется от 20 до 40% и с возрастом увеличивается [1]. Повышенное артериальное давление (АД) обнаруживается более чем у 50% мужчин и женщин старше 60 лет [2]. В России в структуре общей смертности около 56% приходится на сердечно-сосудистые заболевания (ССЗ), причем большинство случаев связано с болезнями, обусловленными атеросклерозом.
В настоящее время сочетание АГ и дислипидемии (ДЛП) определяют как особое состояние – дислипидемическую гипертензию. Несомненно, что у таких пациентов риск ССЗ, связанный с сопутствующими АГ и ДЛП, гораздо больше, чем в случае наличия этих факторов риска отдельно [3].
Наличие у пациента АГ и атеросклероза приводит к прогрессированию обоих процессов, отчасти из-за синергии между повышенным АД и другими атерогенными стимулами, активирующими окислительный стресс в стенках артерий [4]. Доказано, что АГ, как и ДЛП, вызывает окислительный стресс в артериальной стенке. Сам по себе повышенный уровень АД способен повреждать эндотелий в результате гемодинамического удара и активации окислительного стресса, что приводит к повышению синтеза коллагена и фибронектина эндотелиальными клетками. Регуляция синтеза оксида азота (NO) зависит от сосудистой релаксации и повышения проницаемости для липопротеидов [5, 6]. Высказывалось предположение, будто супероксид-анион может вызывать развитие гипертензии в некоторых моделях, по-видимому, путем инактивации эндотелием такого вазодилататора, как NO [7].
Атеросклероз приводит к структурным изменениям, в результате которых происходит снижение эластичности стенок крупных артерий. Повышение жесткости стенок артерий рассматривается в качестве основного патофизиологического изменения, способствующего возникновению АГ [8]. Наличие ДЛП нарушает эндотелиальную функцию из-за уменьшения синтеза NO [9], что в свою очередь может приводить к повышению АД. ДЛП может также усиливать действие на эндотелий вазоконстрикторов эндотелина-1 и ангиотензина II, тем самым повышая АД [10–12]. Повышение уровня липидов в плазме крови, эктопическое накопление липидов и наличие внутриклеточных липидных капель способствуют развитию оксидативного стресса [13, 14].
Взаимодействие реактивного кислорода и азота с белками, липидами и углеводами изменяет структуру и функцию клеточных компонентов [15, 16]. Таким образом, снижение продукции NO в сочетании с повышенным ответом сосудосуживающих медиаторов будет увеличивать АД у пациентов с ДЛП.
Мероприятия по первичной профилактике предусматривают изменение образа жизни и применение не только антигипертензивной, но и интенсивной липидснижающей терапии. Актуальность коррекции ДЛП у больных АГ обусловлена еще и другим: выраженность действия антигипертензивных препаратов зависит от уровня холестерина (ХС) в плазме крови. В исследовании M. Morgado и соавт. показано, что контроль АД у пациентов, одновременно принимающих антигипертензивные средства и статины, составил 54,9%, что было достоверно выше, чем у пациентов, которые получали только антигипертензивное лечение, – 21,4% [17].
С. Borghi и соавт. [18, 19] обнаружили, что у пациентов, получавших сопутствующую антигипертензивную терапию и статины, эффект снижения АД был более выражен, причем это не может быть объяснено исключительно гиполипидемическим эффектом статинов или эффектом антигипертензивных препаратов. Эти результаты показывают, что применение статинов в сочетании с антигипертензивными средствами может улучшать контроль АД у пациентов с неконтролируемой АГ и высоким уровнем ХС в сыворотке крови.

Патофизиологические механизмы, объясняющие влияние статинов на АД, вероятнее всего, связаны с тем, что статины оказывают положительное влияние на эндотелиальные клетки и гладкие мышцы сосудов. В дополнение к снижению уровня липопротеидов низкой плотности (ЛПНП) у статинов есть несколько плейотропных эффектов, связанных с влиянием на маркеры риска сосудистых заболеваний, в т.ч. с уменьшением воспалительного процесса, повышением стабильности атеросклеротических бляшек, улучшением функции эндотелия [20–24]. В ряде источников сообщалось о способности статинов напрямую угнетать Rho/Rho-киназу. Процессы, запускаемые Rho-киназой, играют центральную роль в развитии эндотелиальной дисфункции (ЭД) и гиперспазмирования сосудистых гладкомышечных клеток [25, 26]. В нескольких других исследованиях (in vitro, in vivo) было показано, что статины оказывают физиологическое воздействие независимо от снижения уровня ЛПНП. Например, положительные сосудистые эффекты статинов могут зависеть от их способности изменять уровень высокочувствительного С-реактивного белка (вчСРБ), который индуцирует синтез цитокинов, молекул клеточной адгезии, тканевого фактора в моноцитах и эндотелиальных клетках [27, 28] и активирует рецепторы первого типа к ангиотензину II (АТ1) в гладкомышечных клетках сосудов [29]. Терапия статинами в экспериментальных моделях снижает уровень интерлейкина-1β, вчСРБ в плазме крови независимо от снижения уровня ХС [30].
Ренин-ангиотензин-альдостероновая система (РААС) играет важную роль в регулировании сердечно-сосудистой системы посредством контроля объема внеклеточной жидкости, баланса натрия, функциональных и структурных сердечно-сосудистых эффектов. Гиперактивация РААС связана с развитием АГ, атеросклероза, гипертрофии левого желудочка и сердечно-сосудистых событий, таких как инфаркт миокарда, инсульт и хроническая сердечная недостаточность. Тканевая гиперактивация РААС может приводить к развитию инсулинорезистентности и нарушению уровня липидов. Высокие уровни свободных жирных кислот, ЛПНП и низкий уровень липопротеидов высокой плотности (ЛПВП) могут вызывать дальнейшее нарушение регуляции РААС и способствовать развитию ЭД и атеросклероза вследствие липотоксичности. АГ и ДЛП оказывают схожие воздействия на стенки артерий. Оба процесса приводят к усилению окислительного стресса, активируя гены, участвующие в формировании воспалительной реакции, что при наличии ДЛП приводит к формированию атеросклеротической бляшки. Следовательно, фармакологическая блокада РААС служит перспективным направлением для коррекции как сосудистых нарушений, так и функции эндотелия. Антагонисты рецепторов ангиотензина и ингибиторы ангиотензинпревращающего фермента (иАПФ) являются агентами, непосредственно влияющими на РААС, как блокируя связывание ангиотензина II с рецепторами АТ1, так и уменьшая производство ангиотензина II соответственно [31]. Несколько крупномасштабных клинических исследований показали, что использование антагонистов рецепторов ангиотензина или иАПФ может значительно снизить уровень нарушения толерантности к глюкозе, ДЛП атеросклеротических поражений у больных АГ и/или пациентов с метаболическим синдромом [32–38].
Очевидно, что необходимо проведение исследований с участием пациентов с дислипидемической гипертензией для изучения влияния гиполипидемической терапии на уровень АД и уточнение вкладов непосредственного снижения уровня ХС сыворотки, плейотропных эффектов гиполипидемических препаратов или изучение возможных межлекарственных взаимодействий гиполипидемических и антигипертензивных препаратов.
Нами было проведено открытое проспективное исследование по изучению гипотензивной и гиполипидемической эффективности комбинированной антигипертензивной терапии с помощью иАПФ Фозинотек (фозиноприл) в стартовой дозе 10 мг/сут и тиазидоподобного диуретика Ретапрес (индапамид) в стартовой дозе 1,5 мг в сутки в сочетании с диетой или с добавлением препарата Симвор (симвастатин) в стартовой дозе 20 мг в сутки.
Материал и методы
Основные критерия включения больных в исследование:
- мужчины и женщины в возрасте от 18 до 65 лет;
- гипертоническая болезнь 2-й стадии;
- АГ I–II степеней (систолическое АД – 140–179 мм рт. ст. и/или диастолическое АД – 90–109 мм рт. ст.);
- установленная ДЛП: уровень ХС – более 4,5 ммоль/л и/или ЛПНП – более 2,5 ммоль/л;
- 10-летний риск смерти от сердечно-сосудистых событий по таблице SCORE в пределах 5–9,9%.
Критерии исключения: наличие ССЗ или очень высокий (более 10%) риск их развития, гиперкалиемия (уровень калия в сыворотке выше 5,7 ммоль/л), пациенты с противопоказаниями к применению иАПФ (непереносимость иАПФ, аллергические реакции, двусторонний стеноз почечных артерий или стеноз артерии единственной почки, беременность и лактация).
Соответственно критериям включения 16 больных были рандомизированы в группу, получавшую терапию препаратом Фозинотек (фозиноприл) в дозе 10 мг/сут и препаратом Ретапрес (индапамид) в дозе 1,5 мг/сут, а 18 пациентов получали Фозинотек (фозиноприл) 10 мг/сут, Ретапрес (индапамид) 1,5 мг/сут и Симвор (симвастатин) 20 мг/сут. С включенными в исследование пациентами проводилась беседа о соблюдении диеты, режима приема и дозирования препаратов. Продолжительность исследования составила 12 недель.
Суточное мониторирование АД (СМАД) проведено с применением компьютерной программы обработки данных. Интервалы между измерениями составили 15 минут днем и 30 минут ночью. Определяли суточное максимальное и минимальное систолическое (САД) и диастолическое (ДАД) АД, среднее САД и ДАД в дневные и ночные часы, вариабельность АД в течение суток. Оценивали средние значения САД и ДАД за сутки.
Биохимическое исследование крови (уровни альбумина, креатинина, глюкозы, калия, ХС, триглицеридов, ЛПВП) проводили по стандартным методикам.
Количественное определение микроальбуминурии в утренней порции мочи проводилось на иммунохимическом анализаторе. Границы измерения для данного метода составляют 5–150 мг/л альбумина.
Изучение эндотелиальной функции проведено по методике, предложенной D.S. Celermajer и соавт. с использованием вазодилатационных проб с реактивной гиперемией и нитроглицерином. Нормальной реакцией плечевой артерии в пробе с реактивной гиперемией считали ее дилатацию на 10% и более от исходного диаметра. Нормальным ответом на пробу с 500 мг нитроглицерина считался прирост диаметра плечевой артерии на 20% и более от исходного. Иммунотурбидиметрическим методом, основанным на способности вчСРБ образовывать иммунные комплексы с содержащимися к нему антителами, усиленными латексными частицами, определяли вчСРБ в низких концентрациях (<6 мг/л). Определение проведено с помощью диагностических наборов реагентов на анализаторе белков. ADMA определен ВЭЖХ-тандемным масс-спектрометрическим методом с пределами обнаружения 1 нг/мл.
Все вычисления проведены с помощью математических пакетов «Cтатистика» и SPSS. Рассчитывали среднее значение показателя и его ошибку, пределы колебаний, а также медианы и квартили. При сравнениях средних значений в группах применяли дисперсионный анализ. При сравнении параметрических данных до и после лечения р рассчитывали с помощью t-критерия для связанных выборок, для непараметрических данных – тест Вилкоксона для связанных выборок. Различия считали достоверными при значении р<0,05.
Результаты
Исследование полностью закончили 16 больных группы фозиноприла (выбыли 2 человека) и 18 пациентов группы комбинированной терапии (выбыл 1 человек). Причиной прекращения терапии исследуемыми препаратами был в 2 случаях сухой кашель, 1 выбыл по немедицинским причинам. Больные, распределенные в сравниваемые группы, по основным исходным клинико-демографическим показателям достоверно не отличались друг от друга (табл. 1).
В обеих группах к концу исследования было достигнуто достоверное (р<0,05) сопоставимое снижение как САД, так и ДАД (рис. 1).
В группе, получавшей Фозинотек (фозиноприл) и Ретапрес (индапамид), снижение САД составило 11,44±4,82 мм рт. ст., а в группе, получавшей Фозинотек (фозиноприл), Ретапрес (индапамид) и Симвор (симвастатин), САД уменьшилось на 12,45±3,22 мм рт. ст. Динамика ДАД составила у пациентов, получавших Фозинотек (фозиноприл) и Ретапрес (индапамид), 6,25±2,65 мм рт. ст., а в группе, получавшей Фозинотек (фозиноприл), Ретапрес (индапамид) и Симвор (симвастатин), ДАД уменьшилось на 7,11±3,92 мм рт. ст.
Целевых значений САД (менее 140 мм рт. ст.) достигли только 2 пациента группы, получавшей фозиноприл и индапамид, а целевых значений ДАД (менее 90 мм рт. ст.) достигли 10 пациентов группы, получавшей фозиноприл и индапамид, и 13 больных из группы, получавшей фозиноприл, индапамид и симвастатин.
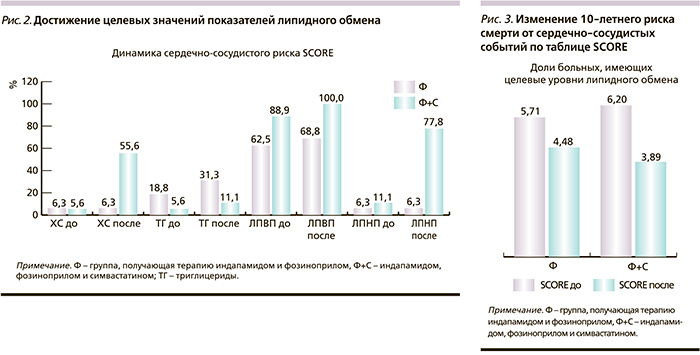
Влияние терапии на уровни липидов и вчСРБ представлено в табл. 2. В обеих группах отмечено достоверное снижение концентрации ЛПНП. Однако степень этого снижения была достоверно большей в группе пациентов, получавших фозиноприл, индапамид и симвастатин.
Доля больных, достигших целевого уровня ХС <4,5 ммоль/л, уровня ЛПНП <2,5 ммоль/л, ЛПВП для мужчин более 1,0, а для женщин больше 1,2 ммоль/л, была большей в группе терапии фозиноприлом и симвастатином, в то же время доля больных, достигших целевого уровня триглицеридов <1,7 ммоль/л, была больше в группе, получавшей терапию только индапамидом и фозиноприлом (рис. 2). Вероятнее всего, это можно связать с исходными данными – в этой группе частота нормальных значений уровня триглицеридов до включения в исследование была в 3 раза выше, чем в группе пациентов, получавших дополнительно симвастатин.
Уровень вчСРБ достоверно не менялся ни в одной из групп, однако при оценке его динамики можно отметить, что в группе терапии препаратами Фозинотек (фозиноприл) и Ретапрес (индапамид) вчСРБ снизился у 9 (56,25%) пациентов в среднем на -1,10±1,14 мг/л, а у 7 пациентов он повысился на 1,2±0,76 мг/л; в группе комбинированной терапии с препаратом Симвор (симвастатин) снижение уровня вчСРБ наблюдалось у 13 (76,47%) пациентов на -0,56±0,38 мг/л, а повышение всего у 4 пациентов на 0,29±0,21 мг/л. Одного пациента группы терапии препаратами Фозинотек (фозиноприл), Ретапрес (индапамид) и Симвор (симвастатин) исключили из анализа ввиду повышения вчСРБ до 24 мг/л на фоне вирусной инфекции.
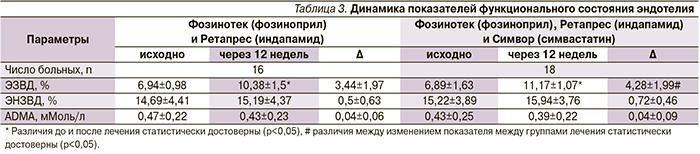
Проводимое лечение сопровождалось достоверным снижением индекса SCORE в обеих группах, но его степень снижения была достоверно более выраженной в группе комбинированного лечения с Симвор (симвастатин) (рис. 3).
Данные о влиянии терапии на показатели эндотелиальной функции представлены в табл. 3.
При проведении пробы с реактивной гиперемией через 3 месяца лечения в обеих группах было выявлено достоверное увеличение ЭЗВД. Cтепень увеличения вазодилатации в группе комбинированной с Симвор (симвастатин) терапии была больше, чем в группе без статина, хотя эти различия недостоверны. В нашем исследовании было отмечено одинаковое снижение ADMA на 0,04 ммоль/мл в обеих группах лечения.
Обсуждение
Полученные в проведенном нами исследовании данные показали, что у больных АГ и ДЛП терапия препаратами компании Ранбакси: Фозинотек (фозиноприл), Ретапрес (индапамид) – привела к ожидаемому снижению АД. Однако пациентам высокого сердечно-сосудистого риска необходима не только коррекция уровня АД, но и нормализация показателей липидного обмена, что достигается при добавлении к антигипертензивной терапии препарата Симвор (симвастатин) [39].
Комбинированная терапия
Фозинотеком (фозиноприл), Ретапресом (индапамид) и Симвором (симвастатин) имеет преимущество по сравнению с терапией без включения статина. Проводимое комбинированное с симвастатином лечение гораздо больше снижало риск сердечно-сосудистых событий, а также гораздо интенсивнее влияло на липидный обмен, уровни вчСРБ, асимметричного диметиларгинина (АДМА), показатели эндотелиальной функции.
В ряде исследований показано, что статины способны снижать АД. Мета-анализ 20 РКИ показал, что САД было достоверно ниже (в среднем на 1,9 мм рт. ст.) в группе пациентов, которые дополнительно к антигипертензивной терапии получали статины. Причем в подгруппе пациентов с исходно более высокими значениями САД (>130 мм рт. ст.) снижение САД было более значимым (-4,0 мм рт. ст.). Гипотензивный эффект статинов по влиянию на ДАД был также достоверно значимым – снижение на 0,9 мм рт. ст., а в подгруппе лиц с исходно более высоким ДАД (>80 мм рт. ст.) – 1,2 мм рт. ст. Влияние статинов на снижение АД не зависело от возраста пациентов, длительности наблюдения, исходного и достигнутого содержания в крови общего ХС или ЛПНП, сопутствующего антигипертензивного лечения. Недавно проведенный мета-анализ показывает, что уровень САД у больных, принимающих статины, значительно ниже, чем в группе пациентов, принимающих плацебо или другие гиполипидемические препараты (среднее различие: -1,9 мм рт. ст. при 95% доверительном интервале [ДИ] – от -3,8 до -0,1). Эффект выражен больше, если анализ ограничивается исследованием САД>130 мм рт. ст. (дельта САД: -4,0, 95% ДИ – от -5,8 до -2,2). Существует тенденция для снижения ДАД у пациентов, получающих статины, по сравнению с контрольной группой: -0,9 мм рт. ст. (95% ДИ – от -2,0 до 0,2) в целом и -1,2 мм рт. ст. (95% ДИ – от -2,6 до 0,1) в исследованиях с ДАД>80 мм рт. ст. Отмечено, чем выше исходный уровень АД, тем более выражен гипотензивный эффект статинов. Снижение АД при приеме статинов не зависит от возраста, изменения уровня ХС в сыворотке крови или продолжительности исследования [40].
В исследовании Brisighella Heart Study эффекты симвастатина по контролю АД были ограничены двумя верхними квартилями САД≥140 мм рт. ст.
В частности, среднее снижение АД было лучше у пациентов в четвертой квартиле, чей контроль уровня АД был невысок, несмотря на прием антигипертензивных лекарственных препаратов. С другой стороны, никаких существенных изменений в АД не наблюдалось у пациентов в двух нижних квартилях с нормальными значениями базового АД (САД<140 мм рт. ст.). Таким образом, использование статинов может существенно улучшить контроль АД у пациентов с ДЛП и неконтролируемой АГ [41]. Однако стоит отметить, что в исследованиях ASCOT и GREACE комбинация иАПФ со статином также не продемонстрировала преимуществ перед монотерапией в плане снижения АД [42, 43]. В нашем исследовании не удалось показать, что добавление симвастатина приводит к усилению гипотензивного эффекта иАПФ. Отсутствие дополнительного снижения АД в нашем исследовании можно объяснить тем, что «гипотензивный эффект статинов», вероятнее всего, не прямой, а эндотелий-опосредованный, т.е. для его реализации необходим более длительный период наблюдения.
ДЛП и АГ связаны с ЭД, и их сосуществование вызвано увеличением числа сердечных событий в эпидемиологических исследованиях. ДЛП и АГ имеют синергетическое отрицательное воздействие на эндотелиальную функцию, связанную с повышенным окислительным стрессом [44]. Выявлено, что ЛПНП и вчСРБ вызывают активацию рецептора АТ1 [45, 46]. Ангиотензин II активирует супероксид-анион и тем самым дополнительно усугубляет ЭД [47, 48]. Соответственно, при сочетании статина и иАПФ терапия может иметь дополнительные положительные эффекты независимо от влияния симвастатина на уровень АД. При проведении пробы с реактивной гиперемией в нашем исследовании через 3 месяца лечения в обеих группах было выявлено достоверное увеличение прироста диаметра плечевой артерии. Хотя степень увеличения вазодилатации в группе комбинированной терапии с симвастатином была больше, чем в группе без статина, данные статистически недостоверны. Способность статинов улучшать эндотелиальную функцию была подтверждена огромным числом исследований [49]. Статины способны прямо воздействовать на функциональную активность эндотелиальной NO-синтетазы (еNOS), вызывая увеличение ее экспрессии преимущественно за счет посттрансляционных механизмов [50]. Увеличение активности еNOS приводит к повышению выработки NO, за счет которого осуществляется регуляция многообразных физиологических процессов на люминальной поверхности эндотелия. Вероятно, отсутствие статистической значимости полученных результатов можно объяснить тем, что улучшение функциональных ресурсов сосудистого эндотелия при применении статинов требует более длительного применения. Аналогично, несмотря на коррекцию липидов при краткосрочном наблюдении в исследовании J.A. Vita и соавт. (2000), у больных ишемической болезнью сердца после приема симвастатина в течение 6 месяцев значимого улучшения ЭЗВД не отмечено [51].
Эндотелиальная функция во многом зависит от продукции и биодоступности NO. В первую очередь на формирование ЭД влияет нарушение образования NO под действием изоформ синтетазы оксида азота. Второй контролирующий процесс – скорость образования ингибитора NO – АДМА. Содержание АДМА значительно повышается при АГ и способствует быстрому прогрессированию атеросклероза, на сегодняшний день АДМА – ранний предиктор поражения сосудов при АГ в связи с его способностью усугублять ЭД путем снижения биодоступности NO [52]. Показано, что блокада РААС приводит к некоторому уменьшению содержания ADMA [53]. Длительное применение иАПФ вызывает снижение уровня АДМА, повышает содержание NOx и уменьшает отношение L-аргинин/АДМА у пациентов. Выявлено, что иАПФ снижают плазматическую концентрацию АДМА независимо от АД [54]. Статины улучшают функцию эндотелия, повышая активность еNOS, в то же время не во всех исследованиях терапия статинами значимо изменяла уровень ADMA [55]. В нашем исследовании было выявлено сопоставимое снижение уровня ADMA на фоне терапии фозиноприлом и при добавлении к нему симвастатина.
Снижение уровней общего ХС и ЛПНП в настоящем исследовании было достоверно больше в группе пациентов, получавших фозиноприл, индапамид и симвастатин. Подобные данные наблюдались в исследовании PHYLLIS: на фоне приема фозиноприла отмечено снижение уровней общего ХС и ХС ЛПНП, хотя и не столь значительное, как при приеме статинов. Антиатеросклеротический эффект фозиноприла, вероятнее всего, связан с блокадой тканевой РААС [56]. Уровень вчСРБ как основного противовоспалительного маркера достоверно не менялся ни в одной из групп, однако при оценке его динамики можно отметить, что в группе комбинированной терапии с симвастатином отмечена тенденция к снижению уровня вчСРБ у 76,47% пациентов, а в группе фозиноприла – только у 56,25%.
В клинической практике уровень вчСРБ в плазме крови <1 мг/л рассматривается как показатель низкого риска, а уровень >3 мг/л – высокого. Необходимо отметить, что после внедрения статинов в клиническую практику их способность редуцировать концентрацию СРБ в плазме крови на 20–30% стали рассматривать как одну из целей терапии. Причем статины способствуют снижению вчСРБ в плазме крови независимо от их гиполипидемического эффекта, что позитивно отражается на прогнозе пациентов.
Заключение
Полученные нами данные свидетельствуют: комбинированная терапия пациентов с дислипидемической гипертензией с использованием иАПФ и статина способна значительно снижать риск сердечно-сосудистых событий. Причем при равном антигипертензивном действии комбинация фозиноприла с симвастатином была значительно эффективнее терапии фозиноприлом в плане снижения риска основных сердечно-сосудистых осложнений. Усиление клинического эффекта при комбинации иАПФ со статинами, вероятнее всего, можно объяснить не синергизмом их гипотензивного или гиполипидемического эффектов, а взаимоусиливающим ангиопротективным действием у пациентов с АГ и ДЛП.
Широкое применение в клинической практике комбинированной антигипертензивной и гиполипидемической терапии позволит снизить риск развития сердечно-сосудистых и цереброваскулярных осложнений у больных АГ с дислипидемией.


