Пищеварение – это сложный, многоэтапный и многокомпонентный физико-химический, физиологический процесс, в основе которого лежит ферментативное расщепление сложных молекул пищи на простые. Процесс пищеварения строится по конвейерному типу, непрерывен, но разбит на определенные этапы. Пищеварение начинается в полости рта, продолжается в желудке и завершается в тонкой кишке. Большое значение для пищеварения имеют такие органы, как печень с системой желчевыводящих путей (ЖВП) и поджелудочная железа (ПЖЖ). В двенадцатиперстной кишке (ДПК), как на перекрестке, объединяются все основные пути пищеварительного механизма: желудочный, печеночный, панкреатический и собственно тонкокишечный. Функции всех органов, участвующих в пищеварении, взаимосвязаны. Известно влияние ДПК на функции желудка, печени, желчного пузыря, ПЖЖ и дистальные отделы тонкой кишки.
В настоящее время за основу взята теория пищеварения, созданная выдающимся ученым Уголевым А.М. (1985). В ее основе лежит представление о трех важнейших этапах пищеварения: полостное, осуществляемое в полости тонкой кишки; мембранное, проходящее на мембранах всасывающих кишечных клеток; внутриклеточное пищеварение и всасывание.
После предварительной желудочной фазы пищеварения содержимое желудка проходит глубокую дальнейшую механическую и химическую обработку в ДПК. Гидролиз пищевых останков в ДПК осуществляется в щелочной среде за счет кишечного секрета, поступления желчи и секрета ПЖЖ. В ДПК как в части тонкой кишки параллельно идут процессы пищеварения, всасывания и выделения. ДПК в пищеварительном процессе занимает исключительную роль, являясь центральным узлом, регулирующим секреторную и моторно-эвакуаторную деятельность всего желудочно-кишечного тракта (ЖКТ). Здесь выделяется секретин, возбуждающий секреторную деятельность ПЖЖ и тормозящий желудочную секрецию. В ДПК также образуется основной стимулятор функции желчеотделения – холецистокинин, влияющий и на ферментообразование ПЖЖ. В ДПК клетками, продуцирующими гормоны, регулируются многие физиологические процессы, в т. ч. пищеварительные и обменные.
Секреторная функция ДПК состоит в продукции и секреции дуоденального (кишечного) сока. Кишечный сок является продуктом функционирования железистого аппарата слизистой оболочки, имеет слабощелочную реакцию, содержит слизь, энтерогормоны и пищеварительные ферменты, участвующие в расщеплении белков, жиров и углеводов. Кроме того, в кишечном соке имеются различные ферменты и биологически активные вещества, продуцируемые печенью и ПЖЖ. Основными факторами, стимулирующими отделение кишечного сока, является механическое и химическое раздражение желез ДПК пищевыми массами, продвигающимися по просвету органа.
Процесс пищеварения белков в полости ДПК осуществляется протеолитическими ферментами ПЖЖ (трипсин, химотрипсин, эластаза, карбоксипептидазы А и В). Одновременно панкреатической α-амилазой расщепляются углеводы (крахмал, гликоген) с образованием в основном дисахаридов и небольшого количества глюкозы. Гидролиз жиров осуществляется липазой ПЖЖ при участии желчи, вырабатываемой печенью и поступающей в полость ДПК по ЖВП.
Функция пищеварения тесно связана с моторно-эвакуаторной функцией и построена по принципу обратной связи. Аппарат желчевыделения функционирует параллельно с ПЖЖ. После приема пищи происходит сокращение желчного пузыря и расслабление сфинктера Одди. Это вызывает эвакуацию содержимого пузыря по общему желчному протоку в ДПК. В ДПК всасываются: сахара, жиры, белки, вода, натрий, хлор, жирорастворимые витамины, витамины В1 и В2, пантотеновая и никотиновая кислоты, кальций, калий, стронций, цинк, железо. Весь процесс пищеварения на кишечном этапе обычно занимает около 6 часов.
Таким образом, ДПК выполняет в целом пищеварительную программу, возложенную организмом на тонкий кишечник. Все пищеварение в данном отделе тонкой кишки можно представить, с одной стороны, как часть общего тонкокишечного гидролитического процесса, с другой – как частный, уникальный этап работы пищеварительного конвейера.
Нарушения пищеварительной функции ЖКТ наблюдаются при различных формах гастрита, дуоденита, язвенной болезни, функциональной патологии органов пищеварения (функциональная диспепсия, дискинезия ЖВП, синдром раздраженного кишечника), аномалиях развития и др.
Расстройство пищеварения клинически проявляется т. н. диспепсией (диспепсическим синдромом) от греческого “плохое пищеварение”, наряду с болевым синдромом определяющей основную симптоматику поражения ЖКТ при любых его заболеваниях. Отдельно выделяются симптомокомплексы нарушения пищеварительной функции желудка (желудочная диспепсия) и кишечника (кишечная диспепсия).
Особенно выражены расстройства пищеварения при длительном, хроническом течении заболевания, сопровождающегося атрофическим процессом в слизистой оболочке желудка, ДПК, тонкой кишки, вторичными изменениями в ПЖЖ, желудке, печени и билиарной системе. Впоследствии возникает нарушение пристеночного пищеварения (синдром мальдигестии), а затем и всасывания (синдром мальабсорбции).
В настоящее время диспепсический синдром, возникающий на фоне функциональной патологии желудка (первичные моторно-сенсорные нарушения) выделен в понятие “функциональная диспепсия” (ФД), которое приобрело смысл нозологической единицы, функционального заболевания ЖКТ, получившего в МКБ-10 шифр К 30 – Диспепсия.
В западной популяции распространенность жалоб диспепсического характера составляет 13–40 % среди больных гастроэнтерологического профиля [1].
Нарушение пищеварительной функции на ранних стадиях хронической органической патологии ЖКТ может протекать бессимптомно, проявляясь при обострении диспепсическими явлениями, среди которых при желудочной патологии отмечаются отрыжка воздухом, срыгивание, тяжесть в эпигастрии после еды, тошнота, иногда рвота. Вовлечение в процесс тонкого и толстого кишечника, ПЖЖ, системы ЖВП сопровождается появлением метеоризма, диареи, запора или их сочетанием.
На последнем заседании Международной рабочей группы по изучению проблем функциональных желудочно-кишечных расстройств, известном как Римский консенсус III (2006), ФК определяется как комплекс клинических симптомов (боли или ощущение жжения в эпигастральной области, либо чувство раннего насыщения и переполнения в подложечной области), возникающих в период не менее чем за 6 месяцев до постановки диагноза и отмечающихся в течение последних 3 месяцев [2]. На основании указанных жалоб по преобладающей клинике выделяется два основных синдрома: эпигастральной боли (язвенноподобная форма, по Римским критериям II) и постпрандиальный дистресссиндром (дискинетическая форма, по Римским критериям II).
Диагноз ФД ставится методом исключения в тех случаях, когда при обследовании (эзофагогастродуоденоскопия – ЭГДС, морфологическое исследование) отсутствуют какие-либо органические, системные или метаболические заболевания ЖКТ, способные объяснить данные проявления [3]. На сегодняшний день ФД рассматривается как гетерогенное расстройство с многообразными этиопатогенетическими механизмами.
Согласно Talley N.J. и Choung R.S. (2009) [4], выделяют следующие этиологические факторы развития ФД:
- наследственность – GNβ3cc-генотип;
- наличие нарушений моторной функции желудка и кишечника;
- инфекция H. pylori;
- психосоциальные факторы.
В России провоцирующими факторами развития данного заболевания являются кроме указанных употребление алкоголя, курение, а также прием нестероидных противовоспалительных препаратов, антибиотиков, теофиллина, препаратов наперстянки и др. Главную роль в формировании симптомов ФД играют нарушения двигательной функции верхних отделов ЖКТ [5–8]. Обсуждается также роль кислотно-пепсического фактора, желудочной гиперсекреции, особенно при болевой форме ФД.
Исследованиями висцеральной чувствительности установлено, что у больных ФД наблюдается снижение порога чувствительности рецепторного аппарата стенки желудка к растяжению – т. н. висцеральная гиперчувствительность. Наличие данного патологического состояния нервно-мышечного аппарата желудка свидетельствует о нарушении сенсорных и афферентных связей между мозгом и ЖКТ. У пациентов с ФД часто наблюдаются и особенности психосоциального статуса, выражающиеся в повышенном уровне тревожности, хроническом стрессе, депрессивности, снижении психологической адаптации, невротических и ипохондрических реакциях. Характерно, что все перечисленные симптомы тесно связаны с симптомами ФД, нередко провоцируют их появление, исчезают после соответствующей медикаментозной коррекции или изменения обстановки, в которой находится больной.
Следует иметь в виду, что в России в отличие от других стран диагноз ФД ставится достаточно редко. Если у больного в процессе обследования не выявляются заболевания, входящие в группу органической диспепсии (язвенная болезнь, гастроэзофагеальная рефлюксная болезнь, опухоли желудка), ему, как правило, выставляется диагноз хронического гастрита. Разграничение этих двух понятий является непростым вопросом как для отечественных, так и зарубежных гастроэнтерологов. Прежде всего следует иметь в виду, что “клинический” диагноз гастрита, т. е. диагноз без морфологического исследования гастробиоптатов, практически не имеет смысла, ведь жалобы – а это, как правило, симптомы диспепсии, носят в большинстве случаев функциональный характер, не сопровождаясь морфологическими изменениями, которые составляют суть гастрита.
Патогенез развития острых и хронических нарушений полостного пищеварения, сопровождающихся явлениями диспепсии, зависит от вида патологии желудка, ДПК, ПЖЖ, печени, ЖВП, тонкой кишки, причем его звенья могут быть задействованы в отдельности, комбинированно и тотально, приводя в конечном счете к той или иной степени мальдигестии/мальабсорбции и нарушению питания больного (трофологической недостаточности).
Рассмотрим пути развития нарушений полостного пищеварения, сопровождающихся симптомами диспепсии.
Причинами нарушения желудочного пищеварения могут быть: ФД; острый гастрит, дуоденит разной этиологии; язвенная болезнь желудка; рак желудка; резекция желудка; хронический атрофический гастрит разной этиологии; ускоренная эвакуация из желудка; вторичное поражение желудка при хроническом дуодените (дуоденостаз, дуоденогастральный рефлюкс – ДГР, гастростаз), в т. ч. при нарушении полостного пищеварения в ДПК.
Перечисленные нарушения вызывают: снижение ацидификации ДПК; синдром избыточного бактериального роста; вторичную экзокринную недостаточность печени и ПЖЖ из-за недостаточной стимуляции выделения холецистокинина; нарушение гидролиза белков и жиров как из-за недостатка пепсина, так и связанное с недостаточной активацией гидролаз в ДПК.
Причинами нарушения пищеварительной функции ДПК являются: диффузное поражение слизистой оболочки при язвенной болезни ДПК, хроническом дуодените (в т. ч. при его инфекционной, лекарственной, иммунной, лучевой этиологии), глютеновой энтеропатии, болезни Крона, амилоидозе и др.; обширные воспалительно-деструктивные поражения слизистой оболочки ДПК, в т. ч. ишемические; резекция; “отключение”; дискинезия (нарушение полноценного контакта с пищеварительными ферментами).
В результате развиваются: недостаточность ощелачивания; нарушение активации ферментов ПЖЖ; недостаточность пищеварительной активности за счет дефицита собственных ферментов ДПК; вторичная гормональная недостаточность ДПК, дефицит регуляторных пептидов; вторичная экзокринная недостаточность ПЖЖ; нарушение моторики, ускорение транзита содержимого; повышенная инактивация энтерокиназы, липазы и других ферментов.
Причинами нарушения пищеварительной функции ПЖЖ являются: первичный хронический панкреатит и вторичный дуоденит; понижение выделения холецистокинина и секретина в связи с воспалительными и атрофическими процессами в слизистой оболочке ДПК; повышение давления в полости ДПК (дуоденостаз) и развитие вторичного хронического панкреатита; вторичный панкреатит, развившийся за счет патологических рефлексов с воспаленной стенки ДПК; патология фатеральной зоны; инактивация энтерокиназы и липазы вследствие закисления полости ДПК и других причин.
При этом наблюдаются недостаточность ощелачивания; ферментная недостаточность; нарушение активации ферментов ПЖЖ, в первую очередь липазы.
Причинами нарушения пищеварительной функции ЖВП могут быть: первичное поражение печени (гепатит различной этиологии) и вторичный дуоденит; холецистит и вторичный дуоденит; желчекаменная болезнь и вторичный дуоденит; дискинезии ЖВП, ассоциированные с хроническим дуоденитом; вторичные нарушения функции гепатобилиарного тракта на фоне хронического дуоденита, папиллита различной этиологии. При этом развиваются: дефицит желчных кислот (ЖК) из-за снижения их синтеза при патологии паренхимы печени, нарушения секреции желчи, инактивации ЖК и их повышенных потерь; дефицит панкреатических ферментов из-за их инактивации при низком рН ДПК (недостаток выделения бикарбонатов с желчью) и недостаточной стимуляции ферментообразования в ПЖЖ; нарушение перемешивания пищи при сопутствующей дискинезии ДПК; вторичное снижение секреторной функции желудка.
Анализируя пути развития нарушений пищеварения в желудке и ДПК независимо от вида первичной патологии, мы обнаруживаем наличие неразрывной связи проксимального отдела тонкой кишки с желудком, ПЖЖ, гепатобилиарной системой и всем ЖКТ в целом. Причем развитию нарушений пищеварения в желудке, ДПК и тонкой кишке в равной степени способствуют как гипер-, так и гипомоторные нарушения, как недостаточность желудочной секреции, так и избыточное закисление или повышение рН-среды ДПК, как недостаточная стимуляция ней ропептидной системы ДПК, так и ее повышенная реактивность.
С другой стороны, чем более выражено нарушение пищеварения в ДПК, тем отчетливее страдают:
- моторная и пищеварительная функции желудка: нарушение гастродуоденальной эвакуации → гастростаз → нарушение секреции желудка → дальнейшее ухудшение пищеварения в ДПК → формирование порочного круга;
- функция печени, билиарного аппарата, поджелудочной железы → нарушение пищеварения в ДПК → нарушение пищеварения в желудке → нарушение гастродуоденальной эвакуации → ДГР → гастростаз → нарушение секреции желудка → дальнейшее ухудшение пищеварения в ДПК → формирование порочного круга.
Впоследствии возникает нарушение пристеночного пищеварения, а затем и всасывания → мальабсорбция и трофологическая недостаточность.Данная порочная круговая система функционирует и при органической, а такжефункциональной патологии желудка, ДПК, ПЖЖ и печени; она неспецифична и многофакторна, однако все ее звенья прочно взаимосвязаны.
Клинически нарушение пищеварительной функции может ярко манифестировать симптомами острой диспепсии при погрешностях алиментарного плана, а на ранних стадиях хронического гастрита или дуоденита протекать бессимптомно, проявляясь при обострении заболевания диспепсическими явлениями, среди которых первое место занимает метеоризм. Кроме того, часто наблюдается неустойчивый стул. В дальнейшем в зависимости от сопутствующего поражения ПЖЖ или системы ЖВП могут отмечаться явления хронической диареи или запора разной степени выраженности.
При снижении желудочного кислотообразования, выраженной микробной контаминации тонкой кишки, несбалансированном выбросе ЖК в ДПК, нарушении их циркуляции в клинической картине будет преобладать диарейный синдром. У пациентов с сопутствующей дискинезией ЖВП диарея чаще имеет гиперсекреторный характер (каловые массы водянистые). Гиперсекреция развивается вследствие нарушения переваривания жиров. Недогидролизованные жиры подвергаются бактериальному гидроксилированию в ДПК, а продукты расщепления и бактериальные токсины, влияя на активный транспорт электролитов и воды, вызывают обильную секрецию последних в просвет кишки. При выраженной стеаторее (внешнесекреторная недостаточность ПЖЖ) каловые массы мазевидные, плохо смываются водой. Несбалансированное поступление в ДПК ЖК (при гипермоторной дискинезии ЖВП и/или при приеме препаратов, содержащих ЖК) также стимулирует процесс секреции в криптах слизистой оболочки кишечника. Диарея может быть обусловленной и гиперосмолярным механизмом, связанным с увеличением количества неабсорбируемых компонентов пищи (белки и углеводы) при синдромах мальдигестии и мальабсорбции. При такой диарее часто наблюдается выраженный метеоризм, развивающийся из-за активности бродильных процессов, процессов гниения (зависит от микрофлоры и преобладающего вида нарушения пищеварения), нарушения рассасывания газа.
Если имеется гиперхлоргидрия, спастико-атоническая моторная дисфункция тонкой и толстой кишки, у пациента наблюдаются явления хронического запора, а при холестазе кал сухой, замазкообразный, кислый, ахоличный, зловонный. При вторичной дисфункции желчного пузыря и/или сфинктера Одди, особенно при сочетании с дискинезией ДПК, нарушается смешивание ферментов с химусом. Это приводит к нарушению полноценного контакта ферментов, желчи и пищевого субстрата, нарушению активации энтерокиназы, гидролаз ПЖЖ. Ухудшают ситуацию дефицит ЖК и низкое рН среды, развивающееся вследствие недостатка бикарбонатов, выделяемых с желчью и секретом ПЖЖ. Значительное закисление проксимального отдела ДПК может возникнуть и вследствие желудочной гиперхлоргидрии на фоне хеликобактерного гастродуоденита, язвенной болезни ДПК.
Снижение желудочного кислотообразования при атрофии желудочного эпителия также ухудшает пищеварение в ДПК, приводя не только к нарушению расщепления белковых и жировых субстратов, но и к повышенной микробной колонизации ДПК и желудка, что не только поддерживает воспаление в ДПК, но и нарушает активность ЖК (бактериальная деконъюгация).
Имеет значение и нарушение чувствительности рецепторного аппарата нейроэндокринной системы ДПК, что также приводит к нарушению регуляции пищеварительной функции печени, системы ЖВП и ПЖЖ. Нарушается в т. ч. чувствительность баро- и осморецепторов. Задача врача – увидеть за явлениями диспепсии формирующиеся патологические процессы в желудке, кишечнике, ПЖЖ и ЖВП, оценить регуляторные расстройства, нарушения пищеварения, питания больного и своевременно начать их полноценную коррекцию.
При явлениях острого гастрита или обострении воспаления в желудке необходимо наряду с диагностикой этиологии гастрита (в частности, его ассоциации с инфекцией H. pylori) и применением при необходимости эрадикационной терапии назначить препараты с антацидным и цитопротективным действием, быстро купирующие тягостные симптомы диспепсии. К таким препаратам относятся современные невсасывающиеся антацидные препараты (Маалокс и др.), обладающие комбинированным защитным действием на слизистую оболочку желудка и ДПК. Маалокс, содержащий в оптимальном соотношении гидроокиси алюминия и магния, наряду с кислотонейтрализующим и ощелачивающим действием обладает очень высокой (на уровне 59–96 %) адсорбирующей способностью по отношению не только к пепсину, но и к агрессивным компонентам желчи (ЖК и лизолецитин), попадающим в желудок при ДГР [9]. Маалокс также характеризуется цитопротективным действием как за счет образования защитного слоя препарата на поверхности эпителия, так и в результате повышения уровня эндогенных простагландинов в слизистой оболочке желудка. Стимуляция синтеза простагландинов приводит к улучшению качества желудочной слизи, нормализации кровотока, что значительно повышает регенераторный потенциал и в целом барьерные свойства слизистой оболочки. Помимо перечисленного немаловажным достоинством Маалокса является и практически полное отсутствие системных, а также побочных эффектов при применении адекватных терапевтических доз препарата.
Кроме невсасывающихся антацидов, особенно при атрофических процессах, также показано применение вяжущих, обволакивающих препаратов (висмута субнитрат, висмута субсалицилат, висмута субцитрат коллоидный, сукральфат и др., фитопрепараты).
При хроническом атрофическом гастрите, дуодените разной этиологии, соответствующем диспепсическом синдроме и лабораторных признаках преобладания нарушений желудочного пищеварения (данные желудочного зондирования, рН-метрии, копрологического исследования и др.) необходимо назначение корригирующей терапии. Прежде всего это назначение диеты, согласно столу № 2 по Певзнеру, препаратов коллоидного висмута и витаминотерапии (витамины группы В, А, С, Е).
У пациентов с хроническим дуоденитом, сопровождающимся нарушением полостного пищеварения, связанного с недостаточностью желчеотделения, низкой ферментной активностью ПЖЖ, выраженное терапевтическое действие оказывают комбинированные полиферментные препараты (ПФП).
В настоящее время на фармацевтическом рынке существует масса ферментных препаратов, которые с определенной степенью условности можно разделить на таблетированные и капсулированные лекарственные средства, содержащие только ферменты ПЖЖ, и комбинированные ферментные препараты (таблетки, драже), в состав которых входят помимо ферментов ПЖЖ компоненты желудочного сока, желчи и ряд других вспомогательных субстанций.
Основными универсальными показаниями к назначению ферментных средств являются острые и хронические нарушения желудочного и кишечного пищеварения, сопровождающиеся явлениями диспепсии.
Терапия нарушений пищеварительной функции теми или иными ферментными средствами зависит от конкретного вида, характера, выраженности и обратимости нарушений пищеварения.
Все ферментные препараты представляют собой лекарственные средства, преимущественно животного происхождения, основным действующим субстратом которых является панкреатин в чистом виде или в комбинации с дополнительными компонентами (ЖК, гемицеллюлазой, аминокислотами, диметиконом, адсорбентами и др.).
Основные группы ПФП, широко используемые в настоящее время:
- таблетированные препараты панкреатина или пищеварительные ферменты растительного происхождения;
- препараты панкреатина с включением компонентов желчи;
- препараты панкреатина или пищеварительные ферменты растительного происхождения, содержащие адсорбенты, диметикон и др.;
- капсулы, содержащие микросферы панкреатина, покрытые энтеросолюбильной оболочкой.
Названия основных ферментных средств и дозы содержащихся в них ферментов представлены в таблице.
Таблица. Сравнительная характеристика (ферментный состав) некоторых современных ПФП.
С учетом в основном билиопанкреатогенного генеза нарушений пищеварения у больных с патологией региона ДПК хорошее терапевтическое действие оказывают препараты, содержащие не только панкреатические ферменты, но и компоненты желчи (Фестал). В целом назначение низкодозовых препаратов панкреатина, содержащих компоненты желчи (Фестал), является методом выбора при диспепсии на фоне хронических заболеваний органов пищеварения (гастрит, дуоденит, холецистит, гепатит и панкреатит вне обострения) и отсутствия истинной панкреатической недостаточности.
Особенно показано назначение Фестала больным с нарушением желчеотделения и развитием дефицита ЖК, при асинхронизме поступления желчи и панкреатического сока в ДПК. Это пациенты с дисфункцией сфинктера Одди и желчного пузыря, холелитиазом, состоянием после операций на билиарном тракте (холецистэктомия), после резекции подвздошной кишки. Введение вместе с панкреатическими ферментами компонентов желчи у данных пациентов способствует тому, что гидролиз жиров начинается вовремя и как результат – происходит купирование явлений диспепсии.
Положительное действие Фестал оказывает и при диспепсии, причиной которой является развитие вторичной внешнесекреторной недостаточности ПЖЖ, развившейся вследствие:
- поражения слизистой оболочки тонкой кишки (снижение секреции холецистокинина и секретина);
- резекции желудка, гастрэктомии;
- гастриномы (инактивация ферментов ПЖЖ);
- недостаточности энтерокиназы;
Кроме того, Фестал показан при билиарной недостаточности у больных алкогольной болезнью печени, часто страдающих диспепсией гепатогенного генеза. Препарат оказывает холеретическое и спазмолитическое действие, корректирует нарушение переваривания жиров, нормализует обмен жирорастворимых витаминов и стероидов, способствует улучшению реологических свойств желчи, препятствуя развитию холелитиаза.
Немаловажное значение для эффективного купирования симптомов кишечной диспепсии с помощью ПФП Фестал является эффект включенной в его состав гемицеллюлазы, облегчающей переваривание растительной пищи. Известно, что эффективность ферментной терапии может снижать употребление пищи, содержащей большое количество клетчатки. Одновременно активное расщепление полисахаридов приводит к улучшению сократительной способности желчного пузыря, усилению моторики кишечника, более эффективному расщеплению жиров. Все это в свою очередь позволяет не только успешно лечить гипомоторную дискинезию ЖВП, но и избавлять пациентов от запоров, уменьшать брожение и образование газов в кишечнике, в т. ч. после алиментарной перегрузки жирной, жареной пищей (переедание).
Другим не менее важным направлением ферментной терапии препаратом Фестал является коррекция диспепсии, связанной с:
- алиментарными погрешностями (переедание, злоупотребление жирной пищей);
- нарушением жевательной функции;
- инволюционными изменениями ЖКТ у пожилых;
- нахождением пациента на длительном постельном режиме, малоподвижным образом жизни.
В перечисленных случаях препарат назначается по 1 драже 3 раза в сутки во время еды. При погрешностях алиментарного характера Фестал принимается один-два дня.
Следует иметь в виду, что у пациентов с избыточным закислением ДПК возможно несвоевременное высвобождение ферментов из лекарственной формы с их частичной инактивацией. В этом случае необходимо назначение кислотосупрессивной терапии с помощью ингибиторов протонной помпы (омепразол и др.) или невсасываемых антацидов (Маалокс). При этом следует иметь в виду сорбирующие свойства Маалокса и не назначать препарат в один прием с ПФП, т.е. через 1–1,5 часа после еды.
В тех случаях, когда присутствие ЖК в препарате нежелательно, главным образом при обострении хронического панкреатита, остром гепатите, гипермоторной дискинезии желчного пузыря, выраженной диарее и др., применяются ПФП, в состав которых компоненты желчи не включены.
Для проведения заместительной терапии при выраженной экзокринной недостаточности ПЖЖ независимо от ее происхождения показано применение высокодозовых микрокапсулированных ПФП (Креон, Панцитрат, Эрмиталь). При тяжелой экзокринной недостаточности ПЖЖ (обильный, мазевидный, “жирный” стул – стеаторея) рекомендуют данные препараты в минимальной дозе (50000 МЕ) липазы на прием пищи. Меньшие дозы ослабляют нарушения пищеварения, но не устраняют их. ПФП для проведения заместительной терапии и коррекции диспепсических явлений назначаются на длительный срок, в ряде случаев – пожизненно. Следует помнить, что порой даже применение больших суточных доз ПФП не купирует стеаторею полностью. Это может быть связано с инактивацией ферментов в ДПК из-за сильного закисления ее содержимого либо с разрушением липазы протеазами, содержащимися в самом препарате. В целом же проведение адекватной ферментной терапии при хроническом панкреатите в 80–85 % случаев приводит к купированию диспепсического синдрома за обычный период стационарного лечения (21 день). Количество дефекаций приходит в норму, стул становится оформленным, теряет признаки стеатореи.
Побочные эффекты от приема ПФП обычно связаны с аллергическими реакциями, реже – с диареей. При их длительном применении в высоких дозах возможно развитие гиперурикозурии, повышение уровня мочевой кислоты в плазме крови. Побочные эффекты от назначения ферментной терапии, как правило, редки и не бывают тяжелыми. В настоящее время на основании принципов доказательной медицины разработана стратегия ведения больных, которые впервые обратились с диспепсическими жалобами, предполагающая соблюдение следующих условий:
- правомерность постановки диагноза “функциональная диспепсия” подтверждается наличием доказательств связи симптомов с верхним отделом ЖКТ;
- исключение “симптомов тревоги”, что требует добросовестного дообследования пациентов с целью исключения более тяжелой патологии;
- исключением приема аспирина или других нестероидных противовоспалительных средств;
- при наличии типичных рефлюксных симптомов необходимо поставить предварительный диагноз гастроэзофагеальной рефлюксной болезни и назначить лечение;
- целесообразно неинвазивное определение Helicobacter pylori c проведением эрадикации при положительном ответе проведения – стратегия “test and treat”;
- больным с “симптомами тревоги” или в возрасте старше 40–45 лет показана ЭГДС.
Указанные принципы легли в основу последних алгоритмов ведения пациентов с ФД, разработанных международной группой экспертов с участием российских специалистов, обсужденных и предложенных к использованию на Международной конференции по вопросам гастроэнтерологии и гепатологии, проходившей в январе 2010 г. в Таиланде. Так, для врачей общей практики был предложен несколько упрощенный алгоритм ведения больного ФД (рис. 1) [10].
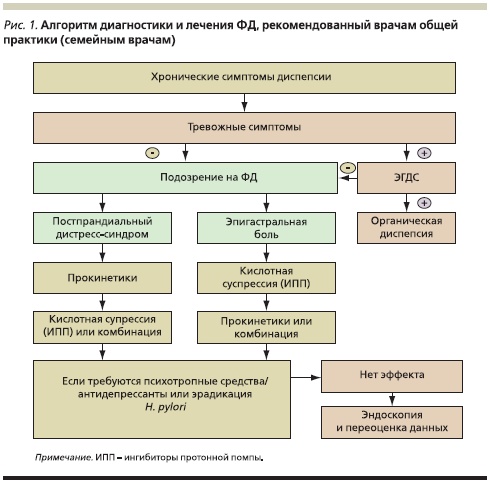
В первую очередь при регистрации у пациента диспепсических жалоб необходимо исключить т. н. симптомы тревоги, к которым относят немотивированное похудание, повторяющуюся рвоту, кровотечение (рвота кровью или “кофейной гущей”, мелена, гематохезия), дисфагию, лихорадку. Это обусловлено прежде всего тем, что ФД при наличии симптомов тревоги маловероятна, а недооценка их важности крайне опасна для прогноза. Данным пациентам независимо от возраста необходимо безотлагательное проведение ЭГДС верхних отделов ЖКТ с прицельной биопсией и морфологическим изучением биопсийного материала. В случае обнаружения органической причины диспепсии (эрозивно-язвенные или опухолевые изменения) устанавливается соответствующий диагноз. В отсутствие таковых формулируется диагноз ФД и проводится лечение в зависимости от клинического варианта синдрома в соответствии с указанным алгоритмом.
Несмотря на то что накопленные на сегодняшний день данные не дают основания считать хеликобактерную инфекцию значимым этиологическим фактором в развитии ФД, проведение эрадикационной терапии способствует исчезновению ее симптомов у 25 % пациентов. В регионах с высокой инфицированностью H. pylori, к которым относится и Россия, оправданна стратегия неинвазивного определения H. pylori с последующей эрадикацией. Если в этом случае эффект не достигается, необходимо повторное проведение ЭГДС с последующей переоценкой результатов, что и отражено в алгоритме для гастроэнтерологов и других специалистов, занимающихся больными ФД (рис. 2) [10].
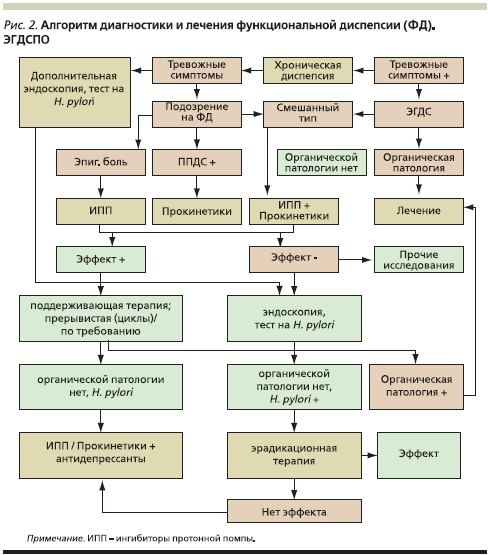
Поскольку основным патогенетическим механизмом возникновения симптомов ФД является дискинезия желудка и ДПК (в основном по гипокинетическому типу), обязательным компонентом лечения при любых клинических формах диспепсии (а при постпрандиальной диспепсической форме – терапией выбора) являются современные прокинетики. Среди препаратов с прокинетическим действием в настоящее время наиболее широкое распространение получили антагонисты дофаминовых рецепторов (метоклопрамид, домперидон), стимуляторы 5НТ4-рецепторов (мозаприд) и новый прокинетик с двойным комбинированным механизмом действия – итоприда гидрохлорид (Ганатон). Использование итоприда при ФД предпочтительнее, т. к. данный прокинетик по сравнению с другими препаратами обладает минимальным спектром побочных эффектов в терапевтическом диапазоне доз (50 мг, 3 раза в сутки), а лечение ФД должно быть длительным – не менее месяца. Все это делает итоприд препаратом выбора при ФД, что и подтверждено многочисленными многоцентровыми исследованиями эффективности данного препарата у больных ФД. Яркой иллюстрацией является последнее исследование, продемонстрировавшее высокую клиническую эффективность (на уровне 75 %) итоприда у 585 больных ФД в Китае (Qi Zhu, 2010) [11], причем побочные эффекты, в основном легкая диарея, были выявлены лишь у 7 пациентов. Следует отметить, что назначение современных прокинетиков (итоприд) показано и в случае диспепсических явлений вторичного характера, т. к. в их основе в большинстве случаев лежат моторные расстройства органов пищеварения. Назначение прокинетиков в комбинации с ПФП и антацидами приводит к более раннему клиническому эффекту.
Что же касается случаев ФД с рефрактерным течением, то на Международном консультативном совете по ФД (Таиланд, 2010) были предложены конкретные алгоритмы ведения подобных пациентов (рис. 3) [12]. Так, пациентам с некупируемым эпигастральным болевым синдромом при неэффективности предшествующей традиционной терапии после исключения патологии передней брюшной стенки (миозита и др.) рекомендуется назначение антидепрессантов, основанное на тех фактах, что рефрактерное течение ФД часто сопровождается наличием выраженной тревоги, явлений депрессии, панических и ипохондрических расстройств. Добавление антидепрессантов к терапии помогает купировать аффективные расстройства, а также ускоряет исчезновение соматической боли. Пациентам, у которых рефрактерный абдоминальный болевой синдром вызван ФД, рекомендуется начинать терапию с трициклических антидепрессантов (амитриптилин 5–50 мг; ≥ 6 недель). При недостаточном клиническом эффекте показаны проведение компьютерной томографии органов брюшной полости, исследование абдоминального кровообращения, исключение абдоминальной ишемии. В случае отсутствия у пациента органической патологии целесообразно дальнейшее продолжение терапии антидепрессантами из групп селективных ингибиторов обратного захвата серотонина и норадреналина (венлафаксин 75–100 мг или дулоксетин 65 мг; ≥ 6 недель) или гибридных средств (миртазапин), которые назначают внутрь перед сном в дозе 15–45 мг/ сут в зависимости от степени наблюдаемых терапевтических и побочных эффектов. Коррекция дозы возможна после 1–2 недель наблюдения. Общая длительность лечения может составлять до 6 месяцев. Указанные препараты действуют как нейромодуляторы, обладающие анальгетическим эффектом, в основном из-за улучшения сна и в меньшей степени – повышения порога болевой чувствительности. Эффективность их несколько выше, чем у трициклических антидепрессантов, а число побочных эффектов значительно меньше.
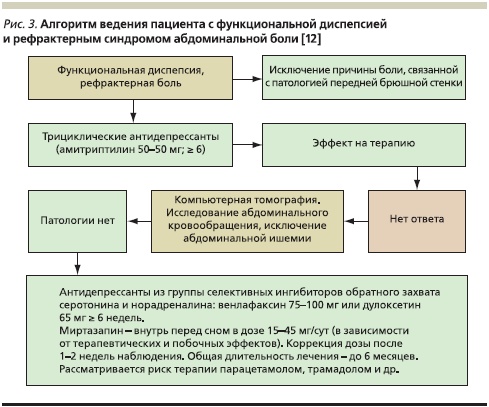
Наряду с рефрактерной абдоминальной болью, связанной с ФД, не менее важной проблемой является рефрактерная желудочная диспепсия, в первую очередь жалобы на постоянную или периодическую тошноту и рвоту. В связи с этим представляет интерес следующий алгоритм ведения пациентов с ФД и рефрактерной тошнотой/рвотой, также сформулированный на консультативном совете по ФД (рис. 4) [12].
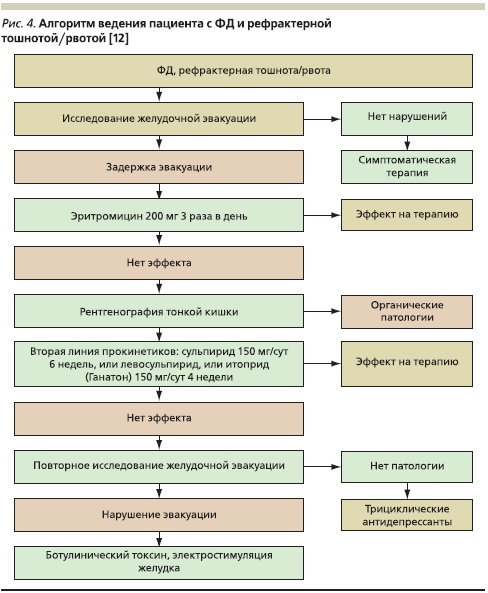
Следует отметить, что данные жалобы встречаются чаще у молодых людей и особенно мучительны в утренние часы, усиливающиеся при волнении и резких колебаниях атмосферного давления. Несмотря на то что рефрактерная рвота – довольно редкая ситуация в клинической практике, круг дифференциальной диагностики при ней весьма велик. В первую очередь следует исключить медикаментозный генез. Второе по частоте место занимают механическая обструкция различных отделов ЖКТ, заболевания центральной нервной системы, наконец функциональные нарушения моторики желудка и ДПК, явления первичной и вторичной псевдообструкции.
Согласно предложенному алгоритму, терапия больных с рефрактерной тошнотой и/или рвотой требует в первую очередь исследования эвакуаторной функции желудка и ДПК. Пациентам с задержкой желудочной эвакуации показано назначение эритромицина в дозе 200 мг 3 раза в сутки, стимулирующего перистальтику антрального отдела желудка и тонкой кишки через мотилинзависимый механизм. Следует отметить, что после 4 недель лечения эффект, как правило, ослабевает. В отсутствие улучшения от проводимой терапии эритромицином целесообразно проведение рентгенографии тонкого кишечника.
Если данные за наличие органической патологии отсутствуют, в качестве препаратов второй линии пациентам показано назначение прокинетиков (итоприда гидрохлорида по 50 мг 3 раза в день на срок от 2 недель до месяца). Это оправданно, поскольку у пациентов с ФД и рефрактерной тошнотой и/или рвотой ведущим этиопатогенетическим фактором является нарушение моторноэвакуаторной функции желудка и кишечника.
В отсутствие ответа на проводимую терапию прокинетиками необходимо проведение повторного исследования желудочной эвакуации с последующей переоценкой результатов. В отсутствие патологии, согласно рекомендациям Tack J.; 2010, возможно начало терапии трициклическими антидепрессантами. При наличии эвакуаторных нарушений, например при диабетическом гастропарезе, и отсутствии эффекта от прокинетиков, возможно применение ботулотоксина или проведение процедур электростимуляции желудка.
Таким образом, явления диспепсии являются серьезным клиническим симптомом, свидетельствующим о нарушении пищеварительной функции ЖКТ как первичного, функционального происхождения, так и возникшем вследствие той или иной органической патологии. В любом случае явления диспепсии требуют тщательной диагностики и своевременного лечения с помощью адекватно подобранной патогенетической терапии современными антацидными, ферментными препаратами и прокинетиками, что обеспечивает полноценный саногенный эффект и значительно повышает качество жизни пациентов.
Информация об авторах:
Маев Игорь Вениаминович – доктор медицинских наук, профессор, заведующий кафедрой пропедевтики
внутренних болезней и гастроэнтерологии МГМСУ. Тел. 8 (495) 683-98-58;
Самсонов Алексей Андреевич – доктор медицинских наук, профессор кафедры пропедевтики внутренних болезней
и гастроэнтерологии МГМСУ. Тел. 8 (495) 683-98-58, e-mail: aleksei.samsonov@gmail.com;
Кучерявый Юрий Александрович – кандидат медицинских наук, доцент кафедры пропедевтики внутренних
болезней и гастроэнтерологии МГМСУ. Тел. 8 (495) 683-98-58;
Казюлин Александр Нисонович – доктор медицинских наук, профессор кафедры пропедевтики внутренних болезней
и гастроэнтерологии МГМСУ. Тел. 8 (495) 683-98-58


