В последние годы развития клинической медицины стало очевидным, что артериальное давление (АД) – непрерывный фактор риска сердечно-сосудистой патологии, поэтому артериальную гипертензию
(АГ) стали определять как такое повышение уровня АД, при котором можно добиться ощутимых (или клинически значимых) преимуществ от снижения АД [1].
Однако в настоящее время нет единого мнения о тактике выбора антигипертензивных средств. Руководствуясь VII отчетом Объединенного национального комитета по выявлению, оценке и лечению артериальной гипертензии США (ОНК VII, 2003), рекомендациями Всемирной организации здравоохранения и Международного общества по АГ (ВОЗ/МОАГ, 2003), лечение АГ следует начинать с тиазидных диуретиков [2, 3].
В рекомендациях Европейского общества по артериальной гипертензии и Европейского общества кардиологов (ЕОГ/ЕОК, 2007), а также Всероссийского научного общества кардиологов (ВНОК, 2008) акцент с концепции выбора препарата первого ряда смещен на достижение целевого АД [4, 5]. При создании нового варианта документа эксперты руководствовались теми же положениями, что и раньше: опираться на все доступные доказательства в ключевых вопросах лечения АГ, включая наблюдательные и другие исследования; избегать жесткой классификации рекомендаций по уровню доказанности лечения; сами рекомендации должны иметь скорее образовательное значение, чем регламентирующие назначения врача [6].
Следуя алгоритму Британского гипертонического общества, выбор препарата зависит от возраста и расовой принадлежности пациента [7]. У пациентов моложе 55 лет белой расы лечение АГ начинают с ингибиторов ангиотензинпревращающего фермента (ИАПФ), или антагонистов рецепторов ангиотензина II, или β-адреноблокаторов (БАБ). Пациентам в возрасте 55 лет и старше или негроидам рекомендуется терапия блокаторами медленных кальциевых каналов или диуретиками.
История использования БАБ в лечении АГ насчитывает уже более 40 лет. Первое сообщение о применении пропранолола при АГ было сделано Prichard B. и Gillam P. в 1964 г. В последующем были синтезированы новые препараты данного класса, выполнено множество клинических исследований, существенно расширились области применения БАБ в кардиологии. В последние 20 лет БАБ рассматриваются в числе основных антигипертензивных препаратов и рекомендованы в качестве средств первого ряда в подавляющем большинстве национальных и международных клинических рекомендаций по лечению АГ [2–5]. Однако данные нескольких ретроспективных мета-анализов результатов клинических испытаний подвергли сомнению целесообразность использования БАБ для стартового лечения неосложненной АГ.
Так, в исследовании LIFE (Losartan Intervention For Endpoint reduction in hypertension study), включившем 9193 больных эссенциальной АГ и электрокардиографическими признаками гипертрофии левого желудочка (ГЛЖ), сравнивали эффективность и безопасность БАБ атенолола и антагониста рецепторов ангиотензина II лозартана. Основным критерием оценки эффективности антигипертензивной терапии был комбинированный показатель частоты развития инфаркта миокарда (ИМ), инсульта и смертности от сердечно-сосудистых заболеваний. Прием лозартана по сравнению с атенололом статистически значимо снижал этот показатель на 13 %; при этом частота развития смертельного или несмертельного инсульта снижалась на 25 %, а частота развития смертельного или несмертельного ИМ была одинаковой в обеих группах [8]. Таким образом, результаты исследования LIFE свидетельствуют о том, что при АГ с ГЛЖ применение лозартана снижает заболеваемость и смертность в большей степени, чем применение атенолола.
В 2005 г. появились новые данные о месте БАБ, в частности атенолола, в современной антигипертензивной терапии. В рандомизированном исследовании ASCOT-BPLA (Anglo-Scandinavian Cardiac Outcomes Trial-Blood Pressure Lowering Arm), включившем 19 257 пациентов с АГ и минимум тремя факторами риска, сравнивали два режима терапии: амлодипином с добавлением при необходимости периндоприла и атенололом с добавлением при необходимости бендрофлуметиазида [9]. В качестве первичных конечных точек были выбраны нефатальный ИМ и фатальная ишемическая болезнь сердца; предлагалось также оценить семь вторичных конечных точек. Несмотря на то что
полученная разница при оценке первичных конечных точек оказалась недостоверной, было обнаружено достоверное различие по шести из семи вторичных конечных точек в пользу группы блокаторов кальциевых каналов и ИАПФ: частота случаев смерти от всех причин была ниже на 11 %, нефатального ИМ и всех случаев смерти от ИБС – на 13 %, всех случаев смерти по сердечно-сосудистым причинам – на 24 %, фатальных и нефатальных инсультов – на 23 %, нефатальных ИМ, фатальных исходов ИБС, фатальной и нефатальной сердечной недостаточности, стабильной и нестабильной стенокардии (“общая коронарная точка”) – на 13 %, всех сердечно-сосудистых событий и процедур реваскуляризации – на 16 %. Это послужило причиной досрочного прекращения исследования. Анализируя его результаты, не стоит забывать о том, что преимущество амлодипина, выраженное в относительных показателях, в абсолютных цифрах явно не столь велико. Для того чтобы предотвратить одну смерть, необходимо пролечить амлодипином 650 пациентов. По мнению самих авторов, в общей популяции это число будет в два раза больше.
В рамках исследования ASCOT проведено дополнительное исследование CAFE (Conduit Artery Functional Endpoint), включившее 2199 пациентов. Его целью была проверка гипотезы о том, что “старые” (атенолол/тиазид) и “новые” (амлодипин/периндоприл) антигипертензивные препараты имеют различные механизмы действия и поэтому по-разному влияют на центральное давление в аорте. Оказалось, что, несмотря на практически одинаковые значения АД в плечевой артерии в обеих группах, центральное систолическое АД (САД) и пульсовое АД в аорте были ниже в группе амлодипина на 4,3 и 3,0 мм рт. ст. соответственно [10]. При проведении повторного анализа частоты клинических исходов в двух группах терапии было выявлено недостоверное снижение частоты комбинированной конечной точки сердечно-сосудистых исходов, сердечно-сосудистых вмешательств, нарушения функции почек в группе амлодипина по сравнению с группой атенолола [11–13].
После публикации результатов вышеуказанных исследований Британское общество АГ исключило БАБ из числа групп антигипертензивных препаратов первого ряда. По той же причине оспаривается возможность начала антигипертензивной терапии с БАБ при сопутствующих сахарном диабете и метаболическом синдроме.
Однако нельзя забывать, что БАБ представляют собой весьма гетерогенную в фармакологическом отношении группу препаратов, единственным общим свойством которых является способность к конкурентной обратимой блокаде β-адренорецепторов 1-го и/или 2-го типов. Многие современные высокоселективные БАБ практически лишены побочных эффектов. Для кардиоселективного БАБ бисопролола доказана безопасность при лечении АГ на фоне сопутствующих сахарного диабета и дислипидемии. Важным свойством бисопролола является пролонгированное гипотензивное действие и возможность однократного суточного приема. В сравнительных исследованиях с использованием амбулаторного 24-часового мониторинга АД выявлено, что эффективность бисопролола в течение 24 часов выше, чем у других препаратов, принимаемых один раз в сутки (например, атенолола или блокатора кальциевых каналов нитрендипина). В двойном слепом рандомизированном исследовании BISOMET показано, что бисопролол сопоставим с метопрололом по степени снижения АД в покое, но значительно превосходит его по влиянию на уровень САД и частоту сердечных сокращений при физической нагрузке [14]. Таким образом, бисопролол оказался предпочтительнее метопролола при лечении АГ, особенно у пациентов с гиперсимпатикотонией. В сравнительном рандомизированном
6-месячном исследовании установлено также, что бисопролол в дозе 10–20 мг/сут вызывал достоверное уменьшение индекса массы миокарда ЛЖ на 11 %, что сопоставимо с эффектом ИАПФ (эналаприла в дозе 20–40 мг/сут) [15]. Кроме того, препарат отличается хорошей переносимостью и улучшает сексуальную функцию [16].
Бисогамма® (Wörwag Pharma, Германия) – один из препаратов бисопролола. В терапевтических дозах (от 2,5 до 10,0 мг) он почти не проявляет блокирующей активности в отношении β2-адренорецепторов. В связи с этим препарат не вызывает таких метаболических эффектов, как гипергликемия и дислипидемия; не оказывает ангиоспастического эффекта на артерии и не вызывает клинических проявлений блокады β2-адренорецепторов бронхов даже на фоне наибольшей концентрации препарата в плазме крови (при использовании максимальной терапевтической дозы 20 мг). Необходимо также отметить у Бисогаммы® наличие кардиопротективных свойств.
Фармакокинетическими особенностями препарата является его высокая биодоступность (> 90 %), способность растворяться как в липидах, так и в воде, что обусловливает двойной путь его элиминации – через печень и почки, поэтому у пациентов с заболеваниями этих органов не требуется коррекции дозы Бисогаммы®.
Материал и методы
С целью изучения гипотензивного эффекта Бисогаммы® и влияния препарата на липидный, углеводный обмен и состояние сосудистой стенки нами были обследованы 48 пациентов с АГ I–II степени, риском сердечно-сосудистых осложнений 1–3 в возрасте от 45 до 65 лет (средний возраст – 51,4 ±6,3 года; 29 мужчин и 19 женщин). Длительность заболевания АГ в среднем составила 5,4±2,1 года. В контрольную группу вошли 20 пациентов (нормотоников), в т. ч. 11 мужчин и 9 женщин, средний возраст – 53,1 ± 5,8 года (р >0,05). Селективный β1-адреноблокатор Бисогамма® применялся в качестве антигипертензивной монотерапии по нарастающей схеме в зависимости от клинического эффекта от 2,5 до 10,0 мг (в среднем 7,5 ± 0,15 мг) однократно в сутки в течение 6 месяцев.
У всех наблюдаемых пациентов с АГ до и после 4- и 6-месячной терапии изучали агрегационную активность тромбоцитов (ААТ), электрофоретическую подвижность эритроцитов (ЭФПЭ). Нормативные показатели реологии крови были определены у нормотоников (20 пациентов), проходящих очередное диспансерное обследование. Исследовали также клинические и биохимические показатели крови: липидный профиль, фибриноген, глюкозу, гематокрит (Ht).
Толщину комплекса интима-медиа (ТИМ) дистальных участков общей сонной артерии (ОСА) и общей бедренной артерий (ОБА) оценивали с помощью допплеровского ультразвукового исследования (УЗИ) в В-режиме по методике Pignolli (1986) на аппарате ELEGRA. Расчет модуля Юнга (МЮ) – отношение нагрузки (сила на единицу площади сосуда) к растяжению (относительное изменение линейного расстояния, определяемого вдоль вектора сила–воздействие) проведено по формуле:
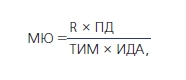
где R – радиус артерии; ПД – пульсовое давление; ИДА – изменение диаметра артерии за один сердечный цикл.
Результаты
Результаты исследования в контрольной группе и группе больных АГ представлены в табл. 1. Обращает на себя внимание исходно повышенное агрегационное состояние тромбоцитов на 55 % в группе пациентов с АГ по сравнению с нормотониками. Аналогично отмечено снижение ЭФПЭ на 42,3 % в группе больных АГ по сравнению с нормотониками. Суммарный показатель липидного профиля – индекс атерогенности (ИА) у больных АГ был почти в 2 раза выше (на 95 %) по сравнению с контрольной группой: 1,84 ± 0,05 и 3,59 ± 0,09 соответственно (р < 0,001). Показатели уровней фибриногена и глюкозы в сыворотке крови в контрольной и исследуемой группах статистически не отличались друг от друга, хотя была отмечена тенденция в сторону их увеличения у больных АГ. В группе больных АГ ТИМ в ОСА превышала на 37 % показатель контрольной группы, в ОБА – на 31 %, что свидетельствует о структурных изменениях сосудистой стенки.
Таблица 1. Исходные результаты исследования реологических параметров кровии УЗИ магистральных сосудов в контрольной и группе больных АГ.
У 5 (10,4 %) пациентов исследуемой группы с коротким анамнезом заболевания (1–2 года) показатели ТИМ были нормальными. Характеризующий функциональное состояние сосудистой стенки параметр МЮ у больных АГ также превышал аналогичный показатель контрольной группы на 24,8 % в ОСА и на 12,7 % – в ОБА.
Таблица 2. Динамика реологических параметров крови, ТИМ и МЮ в зависимости от сроков лечения больных АГ.
В табл. 2 представлена динамика реологических параметров крови и состояния резистивных сосудов в различные сроки лечения больных АГ Бисогаммой®. Установлено, что САД в группе больных АГ через 4 недели и 6 месяцев лечения САД последовательно снизилось на 11,5 и 13,3 %, диастолическое АД (ДАД) – на 14,5 и 16,3 % соответственно. В среднем по группе были достигнуты целевые уровни АД: САД – 133,2 ± 3,7 мм рт. ст., ДАД – 84,7 ± 3,8 мм рт. ст.
ААТ в исследуемой группе в разные сроки наблюдения снизилась на 15,8 и 19,0 %. Выявлена тесная прямая корреляционная связь между уровнем АД и ААТ: rААТ/САД = 0,67 и ААТ/ДАД = 0,72 (р < 0,01).
ЭФПЭ в исследуемой группе после проведенного лечения последовательно увеличилась на 10,8 и 11,1 %. Рост скорости ЭФПЭ находился в тесной обратной корреляционной связи с динамикой уровней АД: rЭФПЭ/САД = -0,56, rЭФПЭ/ДАД = -0,78 (р < 0,01). Качество функционального состояния эритроцитов находилось в тесной корреляционной связи с ИА плазмы: rЭФПЭ/ИА = -0,74 (р < 0,01).
При лечении Бисогаммой® (с сопутствующей гиполипидемической терапией статинами у пациентов с уровнем холестерина > 5 ммоль/л) зафиксировано снижение ИА последовательно на 43,2 и 50,6 % за счет снижения концентрации триглицеридов на 12,4 и 15,1 %, ХС ЛПНП – на 34,5 и 40,9 % и увеличения ХС ЛПВП на 29,7 и 30,6 % (р < 0,01).
Существенных статистически значимых изменений концентраций фибриногена, глюкозы и показателя Ht в сыворотке крови не отмечено. ТИМ в ОСА и ОБА на протяжении всего периода наблюдения не отличалась от исходного уровня (р > 0,05) независимо от программы лечения, что свидетельствует о профилактическом эффекте Бисогаммы® в отношении прогрессирования ремоделирования резистивных сосудов у больных АГ. МЮ – показатель жесткости сосудистой стенки, косвенно свидетельствует о дилатационном резерве сосудов. В исследуемой группе на фоне лечения Бисогаммой® МЮ для ОСА последовательно уменьшился на 13,4 и 16,1 %, для ОБА – на 6,2 и 8,1 %, что указывает на положительную динамику в сторону увеличения дилатационного резерва в резистивных артериях.
Обсуждение
Согласно Национальным рекомендациям по диагностике и лечению АГ [5], первичная цель в лечении АГ – максимальное снижение общего риска сердечно-сосудистых заболеваний в отдаленном периоде. Достижение цели требует снижения уровня АД ниже 140/90 мм рт. ст. в общей популяции больных АГ, а также коррекции всех обратимых факторов риска.
Клинический результат нашего исследования – достижение целевого уровня АД (< 135/85 мм рт. ст.), свидетельствующее об эффективном гипотензивном эффекте монотерапии Бисогаммой®, был достигнут в 89,6 % наблюдений (у 43 из 48 пациентов). Согласно существующей формуле: АД = МОС × ПСС, уровень АД линейно зависит не только от состояния насосной деятельности сердца, показателем которой является минутный объем сердца (МОС), но и от периферического сосудистого сопротивления (ПСС). ПСС в свою очередь, согласно упрощенной формуле Пуазейля, обратно пропорционально зависит от тонуса сосудов, который определяет диаметр просвета сосудов, и прямо пропорционально – от длины сосудистого русла и вязкостных параметров крови, т. е. от реологических свойств крови: ОПСС = L × η/S, где S – площадь просвета сосудов, L – длина сосудистого русла, η – вязкость
крови. Реологические свойства крови включают: глюкозо-белково-липидный состав, количество (Ht) и функциональное состояние форменных элементов, коагуляционный потенциал.
Общеизвестно, что применение селективных БАБ, в частности Бисогаммы®, в лечении АГ направлено на уменьшение МОС за счет отрицательного хроно- и инотропного эффектов (т. е. уменьшения частоты сердечных сокращений и ударного объема сердца). В настоящее время доказано, что повышенное агрегационное состояние тромбоцитов вносит определенный вклад в повышение АД – через секрецию тромбоксана А2, мощного вазоконстриктора. Тромбоцит – сложная по структуре и функции клетка, реализует свое функциональное состояние через адренорецепторы, аналогичные таковым кардиомиоцитов и гладкомышечных клеток сосудов. Поэтому использование БАБ при лечении АГ оказывает эффект “успокоения” тромбоцитов, снижая их чувствительность к катехоламинам, что подтверждается результатами исследований ряда авторов и нашими наблюдениями. По нашим данным, после 4-и 6-месячного лечения Бисогаммой® больных АГ отмечено снижение ААТ суммарно по всей группе на 15,8 и 19 %, косвенно свидетельствующее о наличии в тромбоцитарной мембране β-адренорецепторов.
Увеличение ЭФПЭ суммарно по всей группе больных АГ на 14,6 % на фоне лечения Бисогаммой®, возможно, определяется нормализацией липидного профиля. Известно, что нарушения липидного состава эритроцитарных мембран являются одной из причин снижения способности эритроцитов к деформации, а следовательно, нарушения их подвижности и в целом изменения текучести крови, что способствует повышению ПСС и АД. Нормализация липидного профиля у больных АГ на фоне лечения Бисогаммой® подтверждается результатами наших наблюдений: ИА снизился на 43,1 % преимущественно за счет увеличения ХС ЛПВП на 29,7 % и снижения концентрации ХС ЛПНП на 34,5 %. Аналогичная динамика получена в исследованиях других авторов [17, 18], что указывает на преимущество Бисогаммы®, действующим началом которой является бисопролол (метаболически нейтрален), перед другими БАБ в лечении АГ, которые могут изменять липидный профиль в сторону атерогенности. За период 6-месячного наблюдения не было также зарегистрировано случаев патологического изменения углеводного профиля крови.
В нашем исследовании через 6 месяцев лечения Бисогаммой® отмечено достоверное снижение величины МЮ в ОСА и ОБА, что подтверждает улучшение эластичности сосудистой стенки и косвенно свидетельствует о восстановлении функции эндотелия.
Заключение
Таким образом, Бисогамма® в программе лечения АГ обладает многосторонним действием: помимо прямого влияния на структуры сердечно-сосудистой системы, препарат нормализует реологические свойства крови; способствует снижению ИА, улучшению эластичности сосудистой стенки, что суммарно более эффективно нормализует уровень АД, а метаболическая нейтральность определяет предпочтительное место препарата в длительной терапии пациентов с АГ.


