Злокачественные опухоли тонкой кишки (ЗОТК) встречаются редко – менее 5 % всех опухолей желудочно-кишечного тракта (ЖКТ) [1]. Согласно Международной классификации онкологических заболеваний, к ним относят опухоли двенадцатиперстной кишки, тощей и подвздошной кишки, исключая баугиниеву заслонку, но включая дивертикулы Меккеля [2]. Наиболее частая локализация ЗОТК отмечена в проксимальных отделах кишки.
Классификация и клиника ЗОТК
Среди ЗОТК выделяют эпителиальные (аденокарциномы), нейроэндокринные (карциноиды) и неэпителиальные опухоли (стромальные и лимфомы). Общим для всех ЗОТК является позднее выявление заболевания, обусловленное отсутствием клинических симптомов на ранней стадии, труднодоступностью ТК для диагностики и отсутствием эффективных скрининговых программ.
Клинические проявления ЗОТК в основном неспецифичны и характерны для любого новообразования ЖКТ: ощущение дискомфорта, абдоминальная боль, тошнота, диарея, потеря массы тела, слабость, железодефицитная анемия (ЖДА), лихорадка, кишечная непроходимость, кровотечения.
На долю аденокарциномы тонкой кишки приходится 1,5 % от всех вариантов рака кишечника и до 40–50 % ЗОТК [3, 4]. Средний возраст больных – около 60 лет. К факторам риска развития рака ТК относят: семейный аденоматозный полипоз (аденокарцинома диагностируется в 300 раз чаще, чем в общей популяции), болезнь Крона (риск увеличивается до 31,2 %), синдром Пейтца–Егерса (риск развития карциномы ТК составляет 2–3 %), целиакию [5]. В этих случаях злокачественная трансформация наступает значительно раньше: возраст пациентов может составлять 30 лет и менее.
Наиболее часто аденокарцинома встречается в двенадцатиперстной кишке (65–72 % случаев), реже – в тощей (25–46 %) и подвздошной кишке (5–10 %). Описаны случаи рака ТК в дивертикулах Меккеля, у больных язвенным колитом [2].
Формы роста опухоли: чаще экзофитная (полиповидный, грибовидный и стелющийся узел с изъязвлением в центре), реже – инфильтративная. В большинстве случаев встречается умеренно дифференцированная аденокарцинома, очень редко – первичная слизистая карцинома и перстневидноклеточный рак [2].
Клинические проявления рака ТК при небольших размерах новообразования скудные – ЖДА и кровотечения (в случае язвенно-инфильтративного процесса). Абдоминальная боль, анорексия, потеря массы тела выявляются на поздних стадиях заболевания, когда опухоль прорастает мышечный и серозный слои, брыжейку. При сужении просвета кишки, а также при давлении регионарных метастазов на сосуды брыжейки развивается кишечная непроходимость.
Гастроинтестинальные стромальные опухоли (gastrointestinal stromal tumors – GISTs). И в англоязычной, и в русскоязычной литературе сложилась традиция называть эти опухоли аббревиатурой во множественном числе (в русском варианте ГИСТы). Эти новообразования мезенхимального соединительнотканного происхождения, составляют всего 1 % от всех злокачественных опухолей ЖКТ, но 80 % сарком этой локализации [6]. В ТК (преимущественно в
тощей) ГИСТы встречаются в 25–36 % случаев. Заболеваемость составляет 10–20 случаев на 1 млн в год, при этом выявляется от 2000 до 5000 новых случаев ежегодно. Средний возраст больных – 40–60 лет, среди них 54 % мужчин [6, 7].
Все ГИСТы потенциально злокачественны. Средний диаметр впервые выявленных новообразований составляет 6–8 см, описан случай гигантской (20 см) опухоли [2]. Наиболее характерен экзоорганный тип роста (50–60 %), имитирующий внеорганную опухоль. ГИСТы метастазируют гематогенным путем в печень (60 %), по брюшине (31 %), в кости (6 %), легкие (2 %), головной мозг (1 %). Метастазы в
регионарные лимфоузлы наблюдаются редко.
Лимфомы составляют 18 % от всех ЗОТК. Лимфома Ходжкина (лимфо гранулематоз) встречается в кишечнике крайне редко (менее 0,5 % случаев). Неходжкинская Т-клеточная лимфома с энтеропатией возникает как осложнение целиакии в 20 % случаев. Наиболее распространенными вариантами неходжкинской лимфомы, локализующейся в ТК, являются В-клеточный тип-лимфома западного типа и болезнь тяжелых α-цепей [3].
Лимфома западного типа чаще встречается у мужчин после 50 лет и у детей до 10 лет, тогда как болезнь тяжелых α-цепей (средиземноморская абдоминальная лимфома) поражает прежде сего мужчин в возрасте 20–30 лет. В качестве предрасполагающих факторов развития лимфомы западного типа описаны иммуносупрессивная терапия (кортикостероидны, цитостатики), целиакия, болезнь Крона, вирусные инфекции (герпетическая, цитомегаловирусная, СПИД). Формы роста лимфомы – узловая и диффузная, последняя встречается чаще. При прогрессировании заболевания поражаются лимфатические узлы брыжейки ТК и забрюшинные лимфоузлы.
Клинические симптомы и осложнения лимфомы ТК западного типане отличаются от таковых при опухолях иного морфологического типа тойже локализации. В случае диффузногораспространения обычно наблюдаютсядиарея, синдром экссудативной энтеропатии, приводящий к анасарке [3]. Причиной развития болезни тяжелыхα-цепей считают первичный иммунодефицит, обусловленный врожденнымдефектом синтеза иммуноглобулинов.В качестве этиологического фактора рассматривают также вирусные ибактериальные интервенции (доказательством является положительныйэффект ранней антибактериальнойтерапии). Опухоль поражает слизистуюоболочку и лимфоузлы брыжейки ТК.Клинические проявления аналогичнысимптомам лимфомы западного типа,
преобладает синдром экссудативнойэнтеропатии [3].
Нейроэндокринные опухоли тонкойкишки составляют около половинывсех ЗОТК и состоят из специализированных клеток, вырабатывающихнейроамины и олигопептидные гормоны [2]. Эти опухоли имеют высокий злокачественный потенциал, рискмалигнизации возрастает по мере увеличения их размеров [8].
По морфо-функциональному признаку выделяют шесть форм [2]: изG-клеток (гастрин-продуцирующая –гастринома); энтерохромаффинных(ЕС) клеток (продуцирующая серотонин, гистамин, дофамин, тахи- и брадикинины); D-клеток (секретирующаясоматостатин – соматостинома); изL-клеток (вырабатывающая глюкагони панкреатические полипептиды); ганглиоцитарную параганглиому и мелкоклеточный рак (низкодифференцированная опухоль). три Три последних типа в ТК кишке обнаруживаютсяредко.
Опухоли из ЕС-клеток принятоназывать карциноидами, это наиболеечасто встречающиеся нейроэндокринные опухоли. Подавляющее большинство карциноидов ТК (87–88 %) локализуются в аппендиксе, подвздошнойкишке, 10–11 % – в тощей кишке, вдивертикуле Меккеля – 2–3 %. У 13 % больных карциноид бывает множественным. Метастазы отмечают в регионарные лимфатические узлы и печень,реже – в легкие. Отдаленные метастазывстречаются редко. Клинические проявления карциноидов (карциноидныйсиндром) обусловлены поступлениемв кровь таких нейромедиаторов, каксеротонин, гистамин, простагландиныи др., и включают приливы, удушье,тахикардию, цианоз, изменения артериального давления, абдоминальнуюболь, диарею [9].
Диагностика ЗОТК
Ранняя диагностика ЗОТК представляет большие трудности. При появлении клинических симптомов выявляются уже распространенные формыновообразований [1, 6]. Пальпация живота позволяет обнаружить инфильтрат в брюшной полости.
Копрологические тесты на скрытую кровь: проба Грегерсена (модифицированный гваяковый тест) требует пищевых ограничений не менеечем в течение 3 дней и обладает низкой специфичностью; иммунохимический фекальный тест на скрытуюкровь (FITs) не требует пищевыхограничений, но также обладаетотносительно невысокими чувствительностью и специфичностью (35–50 %); молекулярные тесты определения ДНК, содержащей мутации,высокочувствительны (64–91 %) испецифичны (93–96 %), однако ихиспользование ограничено техническими трудностями и материальнымизатратами.
Среди рутинных инструментальных методов диагностики основным и наиболее доступным является рентгенологический, который включает обзорную рентгенографию брюшной полости для исключения кишечной непроходимости, исследование пассажа контрастного вещества (бариевой взвеси) по ТК в условиях гипотонии, что позволяет определить новообразование и/или его осложнения – перфорацию органа, стеноз. Ультразвуковое исследование (УЗИ) брюшной полости является обязательным скрининговым методом обследования каждого больного с патологией ЖКТ, обладает высокой разрешающей способностью, просто в исполнении, не требует сложной подготовки, позволяет не только диагностировать опухоль, но и выявлять метастазы, проводить диагностическую пункционную биопсию.
Оба метода требуют очень высокой квалификации исследователя ипозволяют диагностировать опухольлишь в половине случаев – обычнона поздних стадиях. Компьютернаяи магнитно-резонансная томографии брюшной полости применяются в качестве дополнительныхдиагностических методов для уточнения локализации, протяженности новообразования, обнаруженияметастазов.
Наиболее перспективными и информативными безусловно следует считатьэндоскопические методы, но тут имеются трудности технического, организационного и финансового характера. Эндоскопия ТК, как правило, ограничивается дистальными отделами(дуоденоскопия, еюноскопия) тощей и дистальными отделами подвздошнойкишок (илеоколоноскопия), проводится далеко не во всех медицинскихучреждениях. Капсульная энтероскопия, к сожалению, используется редко,прежде всего из-за высокой стоимостиисследования. Метод очень информативный, но имеет свои ограничения:
не показан при подозрении на стриктуру ТК и не позволяет выполнятьбиопсию.
Самым ценным на сегодняшнийдень является метод эндоскопическойодно- или двубаллонной интестиноскопии, но он также дорог, выполняется в специализированных центрах,число которых невелико, и требуетанестезиологического пособия.
Окончательный диагноз ЗОТК основывается на результате морфологического исследования новообразования.
В качестве специальных методовследует назвать определение уровнейсеротонина, хромогранина в крови и 5-гидроксииндолуксусной кислоты вмоче с целью диагностики карциноида. При подозрении на лимфому рекомендуется проведение стернальнойпункции и трепанобиопсии, исследование иммунограммы (в крови, слюне,кишечном содержимом).
Прогноз ЗОТК относительно благоприятен только при условии раннего обнаружения, если нет распространения процесса в окружающие ткани и отдаленного метастазирования, что позволяет успешно выполнять хирургическое удаление новообразования или проводить полный курс химиотерапии (при лимфоме).
Клиническое наблюдение
Больной Л. 55 лет, житель Москвы, поступил в отделение гастроэнтерологии МОНИКИ с жалобами на тошноту, эпизоды рвоты 1–2 раза в неделю пищей через час после еды, приносящие облегчение; умеренные боли ноющего характера в эпи- и мезогастрии натощак и через час после еды; прогрессирующую слабость, потливость при физической нагрузке и ночью; похудание на 3–4 кг за последние несколько месяцев; послабление и учащение стула (3–4 раз в день); везикулярные высыпания на слизистой оболочке нижней губы.
В течение последних 8–10 лет эпизодически беспокоят боли в эпигастральной области. Неоднократно проводилась эзофагогастродуоденоскопия (ЭГДС); эрозивно-язвенные процессы желудка и двенадцатиперстной кишки были исключены. Повторные УЗИ брюшной полости патологии не выявили. Исследование крови не проводилось. Ухудшение состояния отметил за 5 месяцев до госпитализации, когда боли в эпигастрии возобновились и стали носить постоянный характер, беспокоила тошнота и рвота. Амбулаторно проведена ЭГДС: в полости желудка содержимое (съеденная накануне пища), осмотр невозможен. Повторно исследование не проводилось. Принимал по назначению врача фосфалюгель. На фоне лечения купированы боли в эпигастрии, однако тошнота и эпизоды рвоты сохранялись; отметил неустойчивость стула со склонностью к поносам. Повторное обследование проведено только через 4 месяца. При ЭГДС – эрозии желудка, гастродуоденит. Выявлена ЖДА – гемоглобин 80 г/л, сывороточное железо 2,4 мкмоль/л; другие показатели лабораторного обследования не представлены. На фоне проведенной в течение 7 дней
терапии (Нексиум 80 мг/сут, Мотилиум 10 мг 3 раза в день) боли в эпигастральной области уменьшились, нормализовался стул. Для уточнения генеза ЖДА был госпитализирован в гастроэнтерологическое отделение МОНИКИ.
При поступлении состояние средней тяжести. Телосложение правильное повышенного питания, гиперстенической конституции. Кожные покровы бледные нормальной влажности, чистые, на слизистой оболочке нижней губы – везикула (герпес?). Лимфатические узлы, доступные при пальпации, не увеличены. Язык влажный, чистый, сосочковый слой сглажен. При пальпации живот мягкий, безболезненный. Печень по правой среднеключичной линии не выступает из-под края реберной дуги, край печени острый, при пальпации безболезненный. Селезенка пальпации не доступна. Стул 1–2 раз в день без видимых патологических примесей, кашицеобразный. Периферических отеков нет. Динамика лабораторных показателей в период госпитализации представлена в таблице.
Таблица.Динамика лабораторных показателей.
Копрограмма: реакция на скрытую кровь положительная, эритроциты – 1–2–3 в п/зр, лейкоциты единичные в п/зр, большое количество слизи.
Анализ данных, полученных на догоспитальном этапе и от результатов первичного обследования в стационаре, выявил прогрессирование тяжести ЖДА.
На основании жалоб, результатов физикального и лабораторного обследований дифференциальный ряд включал: новообразование ЖКТ (рак, лимфома) и эрозивно-язвенный процесс (болезнь Крона, язвенный колит), осложненные хронической ЖДА.
Исследование крови на онкомаркеры: РЭА; СА 19-9 15,7; СА 15-3; СА 125; PSA общ. – отклонений от нормы не выявило.
Данные инструментального обследования
УЗИ органов брюшной полости:
диффузные изменения печени и поджелудочной железы. Кисты левой почки.
Рентгенография желудка: хронический гастродуоденит.
ЭГДС – в теле желудка по большой кривизне слизистая оболочка гиперемирована, отечна, легкоранима.
Заключение: гастродуоденит.
Ирригоскопия: долихосигма.
Колоноскопия: гипертонус левой половины толстой кишки. Полип поперечноободочной кишки.
Таким образом, первый этап обследования не выявил источника кровопотери в верхних и нижних отделах ЖКТ, что потребовало дальнейшего поиска и обследования ТК.
Миелограмма: отмечается раздражение красного ростка (52,2 %) и небольшое увеличение числа плазматических клеток (4 %); изменений, характерных для лимфопролиферативного заболевания не выявлено.
Пассаж бариевой взвеси по ТК: в проксимальных отделах подвздошной кишки создается впечатление о расширении одной из петель с задержкой в ней контрастного вещества. Через 3,5 часа от начала исследования контрастировался терминальный отдел подвздошной кишки без признаков патологии.
Лечение: трансфузия эритроцитарной массы 250,0 № 3, Тардиферон по 1 таблетке 2 раза в день, Омез 20 мг 2 раза в день, Мотилиум 10 мг 3 раза в день, ферментные препараты, антибиотики (Абактал 400 мг 2 раза в день внутрь). Отмечено умеренное клиническое улучшение (тошнота и рвота исчезли), но сохранялись почти постоянные боли в околопупочной области и анемия. Температура тела в пределах нормы.
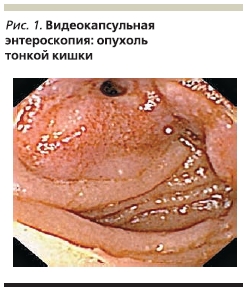
Технических возможностей в МОНИКИ для дальнейшего обследования тонкой кишки не было, и пациент был направлен в ГКБ № 31. При выполнении видеокапсульной эндоскопии выявлено инфильтративно-язвенное поражение тощей кишки с признаками кровотечения, формированием сужений и с наличием фистулы (рис. 1). Проводился дифференциальный диагноз между новообразованием ТК с признаками кровотечения, лимфомой тонкой кишки, свищевой формой болезни Крона.
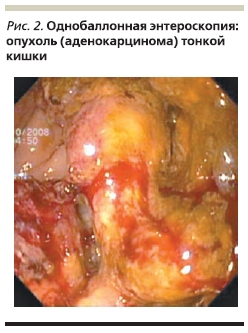
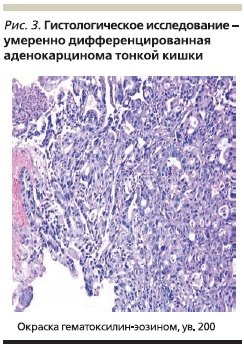
Далее была проведена однобаллонная энтероилеоскопия, при которой в проксимальном отделе тощей кишки в 40 см от привратника обнаружена циркулярная опухоль с бугристыми краями размером до 5 см с глубоким изъязвлением, фибрином в дне язвы и с помарками крови в краях. Слизистая оболочка в зоне образования контактно кровоточит. В одном из краев язвы не исключалось наличие фистулы, в просвете кишки – толстокишечное содержимое. Просвет кишки в данной области резко деформирован, сужен (рис. 2). Проведена множественная биопсия. При морфологическом исследовании верифицирована умеренно дифференцированная аденокарцинома (рис. 3). Выполнена операция: резекция тонкой кишки с энтеро-энтероанастомозом по типу “бок-в-бок”.
При операции обнаружены метастазы в лимфоузлах брыжейки тонкой кишки, метастатический очаг левой доли печени, асцит.
Диагноз: Умеренно дифференцированная аденокарцинома тонкой кишки, Т4N1M1.
Больной направлен к онкологу для решения вопроса о целесообразности лучевой или химиотерапии.
Приведенное клиническое наблюдение демонстрирует редкий случай аденокарциномы ТК и сложность ее диагностики. Обращают на себя внимание ошибки и просчеты на догоспитальном этапе, отсутствие полноценного обследования, несмотря на то что клинические симптомы (тошнота, боль в животе, прогрессирующая анемия) сохранялись в течение нескольких лет. На госпитальном этапе диагноз был заподозрен уже при рутинном рентгенологическом исследовании, проведение которого возможно и на поликлинической уровне. Наличие ЖДА “неясного генеза”, требует включения в дифференциальный ряд любых заболеваний ТК, в т. ч. и в отсутствие синдрома мальабсорбции.


