Улучшение гликемического контроля может снижать риск микро- и макрососудистых осложнений, связанных с сахарным диабетом типа 1 (СД1) [1–3], и врачи-диабетологи постоянно ищут решение, которое помогло бы оптимизировать гликемический контроль, одновременно свести к минимуму приступы тяжелой гипогликемии и увеличение массы тела. Инсулиновые помпы и системы непрерывного мониторирования уровней глюкозы отражают технологии, разработанные в помощь пациентам с СД1, чтобы безопасным путем достичь целевых показателей гликемического контроля. При исследовании взрослых пациентов было показано, что использование инсулиновых помп приводит к снижению уровней гликозилированного гемоглобина (ГГ) без повышения риска развития гипогликемии по сравнению с лечением многократными ежедневными инъекциями инсулина, однако результаты исследований с участием детей противоречивы [4]. Данные недавно проведенных исследований позволяют предполагать, что пациенты, использовавшие помповую инсулинотерапию (ПИТ) с применением сенсора и соблюдавшие условия непрерывного мониторирования уровней глюкозы, добились улучшения показателей ГГ без повышения частоты приступов гипогликемии [5–7]. Аналогично этому в многоцентровом исследовании непрерывного мониторирования уровней глюкозы у пациентов с СД1, спонсированном Фондом Juvenile Diabetes Research Foundation (JDRF; Clinicaltrials.gov NCT00406133), использование устройства для непрерывного мониторирования глюкозы приводило к эффективному снижению уровней ГГ у пациентов в возрасте 25 лет и старше, но не у больных младше 25 лет [8]. ПИТ с использованием сенсора объединяет эти две технологии в одну систему, позволяющую пациентам и врачам наблюдать за лечением и ответом на него с помощью программного обеспечения, работающего через Интернет. Улучшит ли и до какой степени переход непосредственно на ПИТ с использованием сенсора метаболический контроль у пациентов, страдающих СД1, у которых ранее не удавалось достигать целевых гликемических показателей при использовании режима многократных ежедневных инъекций инсулина и традиционного мониторирования уровней глюкозы в крови, неизвестно.
В данном открытом рандомизированном контролируемом исследовании под названием “Эффективность помповой инсулинотерапии с использованием сенсора для снижения показателей А1С (STAR) 3” мы проводили оценку ПИТ с использованием сенсора и инъекционной терапии при участии 30 диабетических исследовательских центров в США и Канаде в течение года [9].
Методы
Пациенты
Пациенты с СД1 подходили для включения в исследование, если их возраст составлял от 7 до 70 лет; они получали лечение многократными ежедневными инъекциями инсулина, включая аналоги инсулина длительного действия, в предыдущие 3 месяца; их показатели ГГ составляли от 7,4 до 9,5 %, и они находились под наблюдением ведущего исследователя или врача в течение последних 6 месяцев. Пациенты должны были иметь доступ к компьютеру и тестировать глюкозу крови в среднем 4 или более раз в день в течение последних 30 дней.
Критерии исключения:
• использование ПИТ в предыдущие 3 года, хотя бы два приступа тяжелой гипогликемии в анамнезе в последний год перед началом исследования;
• использование фармакологических неинсулиновых препаратов для лечения диабета в течение предыдущих 3 месяцев;
• беременность или планирование беременности.
Все пациенты подписывали письменное информированное согласие.
Лечение
Пациенты рандомизировались для получения ПИТ с использованием сенсора или многократных ежедневных инъекций инсулина (инъекционная инсулинотерапия – ИИТ) с использованием блочного дизайна, стратифицированного по возрастным группам: взрослые (19–70 лет) или дети (7–18 лет). Показатели ГГ и глюкозы крови в двух исследуемых группах и показатели уровней глюкозы сенсора в группе ПИТ были известны исследователям и персоналу по уходу за пациентами и самим пациентам для оптимизации уровней ГГ, а также минимизации риска развития тяжелой гипогликемии.
В группе ПИТ использовалось устройство, объединяющее инсулиновую помпу и непрерывное мониторирование уровней глюкозы (MiniMed Paradigm REAL-Time System, Medtronic; рис. 1 в Дополнительном приложении, доступном в полном тексте статьи на сайте NEJM.org). Перед рандомизацией все пациенты проходили обучение по интенсивному лечению диабета, включая подсчет числа углеводов и введение корректирующих доз инсулина. Пациенты вначале получали ПИТ в течение 2 недель, затем вводилось использование сенсоров глюкозы. В течение 5 недель после рандомизации пациенты завершали онлайн-обучение ПИТ и дополнительно посещали обучение по работе с инсулиновой помпой и сенсором. В группе использовался инсулин аспарт (НовоЛог или НовоРапид, Novo Nordisk). В группе ИИТ использовалось два вида инсулина: инсулин гларгин (Лантус, Sanofi-Aventis) и инсулин аспарт, под руководством врача. Показатели глюкозы, зарегистрированные сенсором, учитывались за 1-недельные периоды исходно, через 6 месяцев и через год в обеих исследуемых группах. В группе ИИТ использовалось устройство для непрерывного мониторирования уровней глюкозы, позволявшее учитывать показания глюкозы крови, но не отражавшее полученные данные (Guardian REAL-Time Clinical, Medtronic). Все пациенты проходили осмотр через 3, 6, 9 и 12 месяцев после рандомизации и использовали программное обеспечение для контроля диабета (CareLink Therapy Management System for Diabetes–Clinical, Medtronic). Между посещениями исследовательского центра общение с врачами оставалось на усмотрении пациентов. При катамнестических визитах врач просматривал данные уровней глюкозы, корректировал лечение и измерял уровень ГГ; кроме того, проводился сбор данных по нежелательным явлениям. Эпизод тяжелой гипогликемии определялся как приступ, требовавший помощи третьих лиц и подтвержденный записью об уровне глюкозы в крови ниже 50 мг/дл (2,8 ммоль/л) или восстановления уровня глюкозы в плазме крови. В клинической лаборатории Quest Clinical Trials Laboratory измерение уровней ГГ проводилось методом иммунотурбодиметрии.
Обзор исследования
Экспертный совет организации в каждом исследовательском центре утвердил протокол исследования, и оно проводилось в соответствии с принципами Надлежащей клинической практики (GCP), Хельсинкской декларации и местными законодательными требованиями. Обработка данных и статистический анализ проводились Parexel International, независимой компанией по проведению клинических исследований, которая передавала все данные заказчику – компании Medtronic. Компания Novo Nordisk поставляла весь инсулин аспарт, использованный в исследовании, и компании LifeScan; Bayer Healthcare и Becton Dickinson поставляли глюкометры.
Все авторы имели доступ к данным, написали первый черновой вариант рукописи совместно с представителями компании-заказчика и приняли решение о направлении рукописи в печать. Все авторы гарантируют точность, полноту данных и результатов анализа. Организационный комитет STAR 3 нес ответственность за дизайн и методы исследования [9]. Исследование проводилось в соответствии с оригинальным протоколом за следующими исключениями: пороговый уровень ГГ, приемлемый для включения в исследование, был понижен с 7,5 до 7,4 %; в критериях исключения формулировка “отсутствие использования ПИТ ранее” была изменена на “отсутствие использования ПИТ в течение последних 3 лет”; размер выборки был увеличен с 336 пациентов в 25 центрах до 552 – в 30 центрах; результаты оценки исследования “Hypoglycemia Fear Survey” стали не вторичной, а третичной конечной точкой; система измерения глюкозы Telemetered Glucose-Monitoring System (Medtronic) была заменена на трансмиттер MiniLink (Medtronic) и три визита в течение 5 недель после рандомизации были исключены из расписания в группе ИИТ. (Протокол исследования представлен на сайте NEJM.org.)
Статистический анализ данных
Первичным результатом являлось изменение показателя ГГ через год по сравнению с исходным значением. Частота приступов тяжелой гипогликемии анализировалась как вторичная конечная точка. Мы вычислили, что вовлечение в исследование 495 пациентов даст 90 %-ную мощность для выявления абсолютных различий в процентной точке 0,35 в первичном результате. Анализ проводился по данным всех пациентов, получавших лечение (ITT), т. е. пациентов, у которых был получен хотя бы один результат оценки концентрации ГГ после рандомизации, с переносом последнего измерения вперед (LOST) для условной оценки недостающих данных. Различия изменений показателей ГГ оценивались методом ковариационного анализа (ANCOVA) по трем дискретным переменным (исследуемая группа, объединенный исследовательский центр, пол) и четырем непрерывным переменным (возраст, длительность заболевания диабетом, индекс массы тела и исходный уровень ГГ) как фиксированным эффектам. Доля пациентов, достигших целевых показателей ГГ, анализировалась методом логистической регрессии с тремя дискретными переменными (категории, относящиеся к использованию сенсора, объединенный исследовательский центр и пол) и упомянутыми выше непрерывными переменными как фиксированными эффектами. Изменение веса анализировалось с использованием общей линейной модели с поправкой на исходный вес. Случаи возникновения нежелательных явлений сравнивались методом логистической регрессии, а частоту возникновения нежелательных явлений на 100 пациенто-лет сравнивали методом ANCOVA; в обоих методах использовались две дискретные переменные (исследуемая группа и пол) и упомянутые выше непрерывные переменные как фиксированные эффекты. Площадь под кривой была получена, исходя из степени влияния и продолжительности измеренных с помощью сенсора уровней глюкозы выше или ниже определенного пограничного уровня. Более высокие показатели для этого вычисления указывают на более частые, тяжелые или затяжные гликемические нежелательные явления. Площадь под кривой, вычисленная на основании данных непрерывного измерения уровней глюкозы через год, сравнивалась с использованием метода ANCOVA с тремя дискретными переменными (исследуемая группа, объединенный исследовательский центр, пол) и четырьмя непрерывными переменными (возраст, длительность заболевания диабетом, индекс массы тела и исходный уровень гликозилированного гемоглобина) как фиксированными эффектами. Исходные параметры сравнивались с использованием двухвыборочного критерия Стьюдента для непрерывных переменных и либо метода Хи-квадрат, либо критерия Фишера для дискретных переменных. Анализ проведен с использованием программного обеспечения SAS версия 9.2 (SAS Institute). Все полученные Р-значения двусторонние; Р-значение ниже 0,05 считается указывающим на статистически значимый результат сравнения основных исходов, базальных характеристик и безопасности.
Результаты
Набор пациентов в исследование и исходные характеристики
С января 2007 по декабрь 2008 г. всего 495 пациентов прошли рандомизацию; катамнестические данные по уровням гликозилированного гемоглобина отсутствуют для 10 пациентов, не включенных в первичный анализ. Из оставшихся 485 пациентов 4 (1 %) не присутствовали в данных катамнестического наблюдения, 32 (7 %) отказались от участия в исследовании или были исключены из него и для 6 (1 %) не были предоставлены результаты измерения ГГ за год. Таким образом, в первичном анализе использовались данные 443 пациентов (рис. 2 в Дополнительном приложении). Исходные характеристики в двух исследуемых группах были аналогичными, кроме веса (р = 0,02) и статуса студента (р = 0,02) среди взрослых пациентов (табл. 1).
1 Плюс-минус означает средние значения ± стандартное отклонение. Проценты могут не равняться 100 из-за округления.
2 Раса и этническая группа – по сообщению самих пациентов.
3 Пациенты могли выбрать более одного ответа в данной категории.
4 P < 0,05 при сравнении между группами ПИТ и ИИТ.
Первичные и вторичные результаты
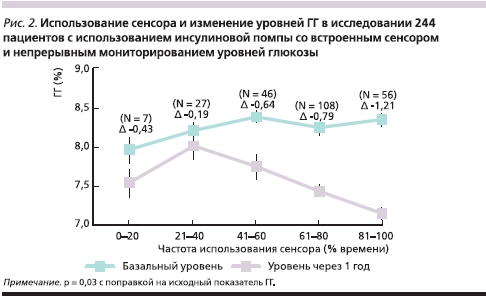
Через год средний исходный уровень ГГ (8,3 % в двух исследуемых группах) снизился до 7,5 % в группе ПИТ (абсолютное снижение – 0,8 ± 0,8 %) по сравнению с 8,1 % в группе ИИТ (абсолютное снижение – 0,2 ± 0,9 %), межгрупповое различие в группе ПИТ -0,6 % (95 % доверительные интервалы [ДИ] от -0,7 до -0,4; p < 0,001; рис. 1). У взрослых пациентов абсолютное снижение среднего уровня ГГ составило 1,0 ± 0,7 % в группе ПИТ и 0,4 ± 0,8 % в группе ИИТ, межгрупповое различие в группе ПИТ -0,6 % (95 % ДИ от -0,8 до -0,4; p < 0,001). У детей абсолютное снижение среднего уровня ГГ составило 0,4 ± 0,9 % в группе ПИТ против увеличения на 0,2 ± 1,0 % в группе ИИТ, межгрупповое различие в группе ПИТ в пользу помповой терапии составило -0,6 % (95 % ДИ от –0,8 до –0,2; p < 0,001) с поправкой на статистический метод. Апостериорный анализ, включивший только данные исследованных пациентов, в котором использовался метод множественного восстановления недостающих значений, дал аналогичные результаты (табл. 1 в Дополнительном приложении). В обеих, взрослой и детской, группах ПИТ уровни ГГ быстро снижались от исходного показателя в течение трех месяцев и оставались более низкими, чем показатели в группе ИИТ в оставшийся период исследования (рис. 1). Увеличение частоты использования сенсоров ассоциировалось с более выраженным снижением уровня ГГ через год (р = 0,03 с поправкой на исходный показатель ГГ; рис. 2). Число пациентов, достигших уровня ГГ ≤ 7 %, составило 67 из 244 (27 %) в группе ПИТ и 23 из 241 (10 %) в группе ИИТ (p < 0,001); в их число входили 57 пациентов из 166 взрослых (34 %) в группе ПИТ и 19 из 163 взрослых (12 %) в группе ИИТ (p < 0,001), а также 10 из 78 детей (13 %) в группе ПИТ и 4 из 78 детей (5 %) в группе ИИТ (р = 0,15; рис. 3).
В апостериорном анализе, в котором использовались целевые показатели для ГГ, рекомендованные Американской диабетической ассоциацией для детей в возрасте от 6 до 12 лет (< 8 %) и подростков в возрасте от 13 до 19 лет (< 7,5 %) [10], суммарно этих показателей через год достигли 35 из 80 детей и подростков (44 %) в группе ПИТ и 16 из 80 (20 %) в группе ИИТ (p = 0,005). У взрослых пациентов отмечено увеличение веса на 2,4 кг в группе ПИТ и на 1,8 кг в группе ИИТ (р = 0,19).
Нежелательные явления
Частота приступов тяжелой гипогликемии и диабетического кетоацидоза были аналогичными в двух исследуемых группах и обеих возрастных группах. Площадь под кривой, вычисленная исходя из данных, полученных при непрерывном мониторировании уровней глюкозы, была аналогичной в двух группах через год у пациентов с гипогликемией (определяется как < 70 мг/дл [< 3,9 ммоль/л] или < 50 мг/дл [< 2,8 ммоль/л]) и была значительно ниже в группе ПИТ у пациентов с гипергликемией (определяется как > 180 мг/дл [> 10,0 ммоль/л] или > 250 мг/дл [> 13,9 ммоль/л]; табл. 2). Через год у 5 из 100 (5 %) пациентов с уровнем ГГ ≤ 7 % были отмечены приступы тяжелой гипогликемии по сравнению с 33 из 395 (8 %) пациентов с уровнем ГГ выше 7 % (р = 0,12). Через год не было отмечено тяжелых приступов гипогликемии ни в одной из детских групп, в которых уровень ГГ составлял ≤ 7 %.
* Более высокие значения площади под кривой указывают на более частые, тяжелые или продолжительные приступы гипогликемии. Площадь под кривой, вычисленная на основании данных непрерывного измерения уровней глюкозы через год, сравнивалась с использованием метода дисперсионного анализа с тремя дискретными переменными (исследуемая группа, объединенный исследовательский центр, пол) и четырьмя непрерывными переменными (возраст, длительность заболевания диабетом, индекс массы тела и исходный уровень ГГ) как фиксированными эффектами. Площадь под кривой оценивалась для пациентов в двух подгруппах по гипогликемии (< 70 и < 50 мг глюкозы на дл) и в двух подгруппах по гипергликемии (> 180 и > 250 мг глюкозы на дл). Р – значения для сравнения числа осложнений основывались на числе пациентов, у которых был отмечен минимум один приступ тяжелой гипогликемии или диабетического кетоацидоза. Р-значения для площади под кривой через год были скорректированы по исходным значениям. Для конвертации показателей уровня глюкозы в ммоль/л следует умножать на 0,05551. NA – “неприменимо”.
В группе ПИТ имели место две госпитализации по поводу панникулита, связанного с инфекцией в месте установки сенсора, в группе ИИТ отмечен один летальный исход по причине внезапной остановки сердца у пациента с сердечно-сосудистым заболеванием в анамнезе.
Обсуждение
В данном исследовании, в котором проводилось сравнение ПИТ с использованием сенсора и многократных ежедневных инъекций инсулина, межгрупповые различия показателей ГГ свидетельствовали в пользу ПИТ и были статистически и клинически значимыми для взрослых пациентов и детей. У большего числа пациентов в группе ПИТ достигнуты целевые показатели ГГ ≤ 7 %, причем более низкие значения концентрации ГГ были обеспечены в этой группе путем снижения биохимической гипергликемии без повышения частоты биохимической гипогликемии или частоты приступов тяжелой гипогликемии. Частота развития диабетического кетоацидоза была незначительной, значимых межгрупповых различий по увеличению веса среди взрослых пациентов отмечено не было.
У взрослых пациентов, у которых средний уровень ГГ составил 8,3 ± 0,5 %, его снижение на 1 % в группе ПИТ было существенно более значимым, чем снижение на 0,4 % в группе ИИТ. Для сравнения: в исследовании JDRF с непрерывным мониторированием уровня глюкозы у взрослых пациентов обеих групп, получавших ИИТ и ПИТ, отмечено снижение уровня ГГ на 0,5 % (среднее исходное значение – 7,6 ± 0,5 %), тогда как в группе со стандартным мониторированием уровня глюкозы концентрация ГГ несколько повысилась [8]. Хотя мы не можем напрямую сравнить полученные нами результаты с данными исследования JDRF, в нашей работе снижение среднего уровня ГГ на 0,5 % у детей в группе ПИТ по сравнению с группой ИИТ не совпадает с результатами JDRF, в котором не наблюдалось межгрупповых различий через 6 месяцев лечения у пациентов в возрасте от 8 до 14 и от 15 до 24 лет. В исследовании JDRF единственными переменными, по которым можно было прогнозировать успешное использование непрерывного мониторирования уровней глюкозы, были более старший возраст и повышенная частота измерений концентрации глюкозы в течение суток [11]. Кроме того, интерес представляют полученные нами данные, согласно которым почти половина детей в группе ПИТ к концу исследования достигла целевых показателей ГГ, установленных Американской диабетической ассоциацией [10]. В других исследованиях сравнивались ПИТ и ИИТ, а также непрерывное и традиционное мониторирование уровней глюкозы в крови с помощью глюкометра. В одном рандомизированном контролируемом исследовании оценивали эффективность одновременного начала применения этих технологий при лечении пациентов, не использовавших ни помпы, ни сенсоры. В нашем исследовании решение об одновременном их использовании по одной за один раз в течение первых 5 недель оказалось эффективным. Клиницисты могут рассматривать этот подход при начале применения помповых систем, оснащенных сенсорами, для лечения пациентов, ранее не сталкивавшихся с этими методами лечения. Так как в проведенных ранее исследованиях оценивалось влияние отдельных компонентов помповой системы, оснащенной сенсором, наше исследование было спланировано с целью оценки эффективности комбинированной системы по сравнению с оптимальной ИИТ. В отличие от результатов, полученных в предыдущих исследованиях, наши данные позволяют предположить, что эффект комбинированной системы более выражен, чем тот, которого можно было бы ожидать при использовании только отдельных компонентов.
В нашем исследовании использование сенсора в течение 41–60 % времени лечения было связано со снижением уровня ГГ на 0,64 %, а повышение времени использования сенсора до 80 % удваивало эффект. Напротив, в исследованиях JDRF (в котором пациенты придерживались режима лечения ПИТ и ИИТ, проводимого до исследования) и STAR 1 (в котором пациенты продолжали ПИТ, начатую до лечения, или переходили на ПИТ с использованием сенсора) более низкие уровни ГГ наблюдались только у пациентов, использовавших сенсор 60 % и более времени [6, 8].
Наблюдаемое нами улучшение гликемического контроля было более выраженным, чем ожидаемые в случае использования простой ПИТ, т. к. в двух недавно проведенных мета-анализах ПИТ в сравнении с ИИТ [4, 12] в группе ПИТ имело место снижение уровня ГГ на 0,3 и 0,2 %. С этой точки зрения дополнительные исследования, спланированные с целью выявления независимых преимуществ сенсоров и инсулиновых помп, были бы оправданными. Вероятно, в нашем исследовании использование программного обеспечения для управления лечением помогло пациентам, применявшим ПИТ с использованием сенсора. Однако мы ограничили влияние этого фактора, сделав программу по управлению данными доступной для всех пациентов. Больные в двух наших исследуемых группах намного реже страдали от приступов тяжелой гипогликемии, чем пациенты с соответствующими показателями ГГ, использовавшие интенсивное лечение инсулином в исследовании Diabetes Control and Complications Trial (DCCT; NCT00360815) [1, 2]. Причиной этого различия может служить большое количество дополнительных благоприятных факторов при лечении диабета – таких, как использование аналогов инсулина [13], изобретенных после начала DCCT, или же исключение пациентов, у которых было 2 и более приступов тяжелой гипогликемии в предыдущем году.
Наиболее выраженное различие между двумя исследованиями состояло в числе приступов тяжелой гипогликемии у детей. В нашем исследовании у детей в группе ПИТ (средний уровень ГГ – 7,9 %) наблюдалось 9 приступов тяжелой гипогликемии на 100 пациенто-лет, тогда как у подростков в исследовании DCCT (средний уровень ГГ – 8,1 %), получавших интенсивную инсулинотерапию, отмечено 85,7 таких приступов на 100 пациенто-лет [1].
Наше исследование имело серьезные ограничения. Во-первых, из-за происхождения используемых устройств медицинского назначения вмешательства были известны пациентам, исследователям и персоналу по уходу за пациентами. Во-вторых, мы не изучали влияние только ПИТ по сравнению с ПИТ с использованием сенсора для определения роли каждого компонента системы. В-третьих, обобщаемость результатов исследования может отчасти ограничиваться использованием заданного диапазона показателей ГГ (7,4–9,5 %) как критерия включения в исследование. В-четвертых, наши пациенты могли только отчасти быть мотивированными, поскольку они принимали участие в исследовании. Однако в целом они соответствовали пациентам с СД1, которые считались кандидатами на дальнейшую интенсификацию инсулиновой терапии и лечения диабета (т. е. у них не удалось достичь желаемых уровней гликозилированного гемоглобина с помощью многократных инъекций инсулина и соответствующего медицинского ухода), и результаты указывают на то, что ПИТ с использованием сенсора является вариантом лечения для таких больных. Наконец, из-за необходимости технического обучения работе с устройствами пациенты в группе ПИТ в первые пять недель исследования должны были чаще контактировать с медицинским персоналом, чем больные в группе ИИТ; поэтому в обеих группах были запланированы идентичные контакты с медперсоналом.
В заключение следует отметить, что у пациентов с СД1 и субоптимальным гликемическим контролем применение ПИТ с использованием сенсора ассоциировалось со значительным улучшением уровня ГГ по сравнению с режимом многократных ежедневных инъекций рекомбинантных аналогов инсулина.
КОММЕНТАРИЙ СПЕЦИАЛИСТА
Новые возможности лечения пациентов с плохо контролируемым сахарным диабетом типа 1
Как известно, во всем мире происходит неуклонный рост числа больных сахарным диабетом (СД), число которых в настоящее время превышает 250 млн чел.
Это диктует необходимость внедрения эффективных методов лечения СД и профилактику его микро- и макрососудистых осложнений, риск развития которых ассоциируется со степенью компенсации углеводного обмена. Показатели гликемии на протяжении суток у больных СД должны оптимально соответствовать установленным терапевтическим целям. Это в полной мере относится к пациентам с СД типа 1 (СД1), в основе которого лежит абсолютный дефицит инсулина, связанный с аутоиммунным поражением β-клеток поджелудочной железы. В настоящее время единственным способом лечения СД1 является интенсифицированная инсулинотерапия (ИИТ), которая должна обеспечивать поддержание целевых показателей углеводного обмена на протяжении всей жизни пациента. При этом должны быть минимизированы частота эпизодов тяжелой гипогликемии и увеличение массы тела пациента.
Традиционно введение инсулина осуществляется с помощью шприцев и шприц-ручек – преимущественно в базис-болюсном режиме: инсулин короткого или ультракороткого действия вводится перед основными приемами пищи, а инсулин пролонгированного действия – 1–2 раза в день, имитируя базальную секрецию. При применении такой ИИТ учесть влияние всех факторов и полностью воспроизвести нормальную секрецию инсулина не всегда удается. Поэтому у части больных развиваются ночные гипогликемии, у других – утренняя гипергликемия, а жизнь пациента на инсулинотерапии протекает в достаточно строгих рамках, снижающих ее качество.
Решить проблему более полной имитации физиологической инсулинемии позволило внедрение в практику метода непрерывного подкожного введения инсулина с помощью инсулинового дозатора (помпы). Применение таких программируемых дозаторов дало возможность отказаться от введения пролонгированного инсулина и оптимизировать базальную инсулинемию за счет введения малых и частых доз ультракороткого инсулина. Кроме того, при использовании помп появилась возможность осуществлять различные варианты болюсного введения инсулина, что делает питание пациента более свободным.
В настоящее время в мире накоплен огромный опыт применения инсулиновых дозаторов. По данным многих авторов, при их использовании удалось существенно снизить частоту гипогликемий и число случаев кетоацидоза, в ряде исследований при этом была уменьшена потребность в инсулине. Абсолютное большинство пациентов отметило улучшение качества жизни.
Следующим шагом на пути оптимизации инсулинотерапии у больных СД1 с целью максимального приближения к физиологической секреции гормона стало создание инсулиновых помп, оснащенных глюкозными сенсорами, обеспечивающими непрерывное мониторирование уровня гликемии. Объединение двух технологий в одну систему должно позволить врачам и пациентам существенно улучшить контроль СД1. При этом используется программное обеспечение, работающее через Интернет. Проведенные в последние 2–3 года исследования свидетельствуют, что помповая инсулинотерапия с использованием сенсора позволяет улучшить показатели гликированного гемоглобина (HbA1с) без повышения частоты эпизодов гипогликемии. Продолжением этих работ стало рандомизированное исследование STAR 3, в котором у почти 500 больных (в т. ч. 156 детей и подростков) с декомпенсированным СД1, в течение года сравнивали эффективность помповой инсулинотерапии в сочетании с использованием сенсора (MiniMed Paradigm REAL-Time System, Medtronic) и инъекционной ИИТ. Важно подчеркнуть, что исследование включало обширную обучающую программу для пациентов.
Результаты проведенного исследования демонстрируют существенные преимущества помповой терапии с сенсором по сравнению с инъекционной ИИТ. Так, при пользовании помпой уровень HbA1c снизился на 0,8 %, тогда как в группе инъекционной ИИТ – только на 0,2 %, причем различий в частоте случаев тяжелой гипогликемии в группах отмечено не было. Важным результатом исследования стало подтверждение эффективности помповой терапии у детей и подростков.
Кроме того, получены данные о том, что добавление к помпе сенсора реально повышает эффективность инсулинотерапии. В частности, было показано, что увеличение продолжительности мониторирования с 40–60 % до 80 % удваивало эффект в отношении снижения уровня HbA1c. Также обращает на себя внимание тот факт, что наблюдавшееся в исследовании STAR 3 снижение уровня HbA1c в группе помповой инсулинотерапии с сенсором было существенно более значимым, чем отмеченное в двух мета-анализах эффективности простой помповой терапии в сравнении с инъекционной ИИТ (-0,2 % и -0,3 %).
Таким образом, у пациентов с плохо контролируемым СД1 помповая инсулинотерапия с применением сенсора имеет очевидные преимущества перед инъекционной ИИТ. По-видимому, по эффективности и безопасности она превосходит и обычную помповую инсулинотерапию, но это требует подтверждения при прямом сравнении в контролируемом клиническом исследовании.
М.Б. Анциферов, профессор, доктор медицинских наук


