Ревматоидный артрит (РА) – наиболее частое воспалительное заболевание суставов, распространенность которого в популяции составляет около 1 %, а экономические потери для общества сопоставимы с таковыми при ишемической болезни сердца [1, 2]. В России РА страдают до 0,6 % населения [3]. Генерализованное аутоиммунное воспаление, свойственное РА, приводит к развитию хронического эрозивно-деструктивного синовита и внесуставным поражениям. РА ассоциируется с ранней инвалидизацией лиц трудоспособного возраста и увеличением кардиоваскулярной летальности как следствием хронического воспаления. Продолжительность жизни больных РА ниже, чем в общей популяции: на 3 года – у женщин и на 7 лет – у мужчин [4]. В последние годы было наглядно продемонстрировано, что улучшить прогноз и исходы болезни могут только своевременная диагностика и раннее активное лечение больных РА [5].
Ранний РА – условно выделенная клинико-патогенетическая стадия заболевания с длительностью активного синовита до года. В зарубежной литературе также выделяют очень ранний РА (“very early RA”) при длительности болезни менее 3 месяцев и поздний ранний РА (“late early RA”) – от 6 до 12 месяцев течения. Ранний РА характеризуется преобладанием в пораженных суставах экссудативных изменений, частым атипичным течением и хорошим ответом на лечение. В случае назначения активного лечения на очень ранней стадии РА достичь ремиссии через 6 месяцев удается среди 47 % больных, а через год – среди 58,1 % пациентов [6]. Таким образом, ранняя стадия РА является стратегически важной для лечения и вместе с тем наиболее сложной для диагностики.
Критерии диагностики РА
До настоящего времени для диагностики РА активно использовались критерии Американской коллегии ревматологов (ACR) пересмотра 1987 г., которые характеризовались достаточно высокими чувствительностью (91– 94 %) и специфичностью (89 %) на развернутой стадии заболевания [7]. Однако при раннем РА они недостаточно информативны. Так, по результатам нашего исследования, чувствительность критериев АСR при длительности заболевания до 3 месяцев составляет 44,8 %, до 6 – 57,03 %, до 12 месяцев – 65,1 % [8]. В 2010 г. ACR совместно с экспертами Европейской антиревматической лиги (EULAR) были представлены новые классификационные критерии РА (табл. 1) с более высокой чувствительностью на ранней стадии заболевания, а также с учетом нового серологического маркера РА – антител к циклическому цитруллинированному пептиду (АЦЦП) [9, 10].
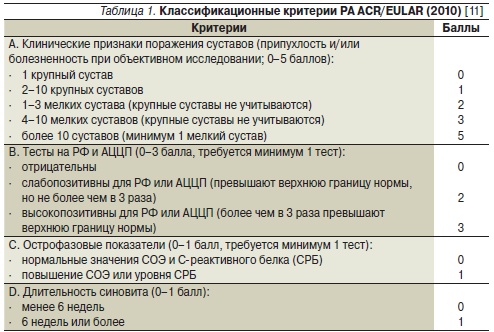
Диагноз РА может быть установлен при общем счете не менее 6 баллов.
Ранний РА может дебютировать как “недифференцированный артрит” (НДА), т. е. артрит, не соответствующий классификационным критериям РА и других ревматических заболеваний.
Выделены следующие клинические варианты НДА [12]:
- олигоартрит крупных суставов;
- асимметричный артрит суставов кистей;
- серонегативный по РФ олигоартрит суставов кистей;
- мигрирующий нестойкий полиартрит.
Пациенты с НДА требуют динамического наблюдения и проведения тщательной дифференциальной диагностики. Иммунологическим маркером раннего РА является обнаружение АЦЦП в сыворотке крови, особенно при отрицательном тесте на ревматоидный фактор (РФ). Серопозитивность по АЦЦП также является фактором риска развития эрозивных изменений в суставах и указывает на возможное неблагоприятное течение РА [13].
В табл. 2 представлено 12 рекомендаций EULAR по ведению больных ранним РА [14]. Первым пунктом является своевременное направление к ревматологу больных с подозрением на ранний РА. Для этой цели может быть использован диагностический алгоритм скрининга пациентов, предложенный еще в 2002 г. группой авторитетных ревматологов [15].
Таблица 2.Рекомендации EULAR (2007) по ведению больных ранним артритом.
В него включены следующие признаки:
- утренняя скованность более 30 минут;
- более 3 воспаленных суставов;
- поражение пястно- и/или плюснефаланговых суставов (положительный тест “сжатия”).
Пациенты с выявленными симптомами синовита должны быть немедленно проконсультированы у ревматолога.
В случае субклинического синовита и в отсутствие изменений на рентгенограммах возможно дополнительное назначение ультразвукового допплеровского сканирования (УЗИ) суставов или магнитно-резонансной томографии (МРТ). Данные методы обладают более высокой, чем рентгенография, чувствительностью при выявлении признаков синовита и эрозий костной ткани. Недостатком УЗИ являются диагностические сложности при исследовании мелких суставов кистей и стоп, а также при количественной оценке эрозий. Наиболее точно оценить не только эрозивные, но и преэрозивные (отек костного мозга, ревматоидный остеит) изменения костной ткани позволяет МРТ суставов. По данным МРТ кистей, у 100 % больных уже на очень ранней стадии РА удается выявить костный отек, у 96,15 % – эрозии и у 92,3 % – признаки синовита [16].
Современные принципы терапии РА [17]
Главная цель лечения РА – достижение ремиссии (индекс активности DAS28 < 2,6) или минимум низкой активности заболевания (DAS28 < 3,2).
Для этого необходимы:
- Ранняя активная терапия базисными противовоспалительными препаратами (БПВП) в дебюте болезни.
- Тщательный контроль (“tightконтроль”) изменений активности заболевания и коррекция терапии (не реже 1 раза в 3 месяца). Ежемесячный контроль активности заболевания должен проводиться у больных с высокой и умеренной активностью.
- Общепризнанным методом оценки активности РА является расчет индекса DAS28, который можно автоматически произвести на сайте www.das-score.nl.
При выборе терапии необходимо учитывать наличие у пациентов с ранним РА маркеров неблагоприятного прогноза [18]:
- молодой возраст;
- женский пол;
- высокие титры РФ и/или АЦЦП;
- эрозивный процесс в суставах по данным рентгенографического или МРТ-исследования;
- повышение уровней острофазовых показателей: СОЭ или СРБ;
- высокая активность заболевания согласно индексам DAS28, SDAI или CDAI;
- внесуставные проявления (синдром Шегрена, поражение легких и т. д.)
Нестероидные противовоспалительные препараты (НПВП)
Назначение НПВП должно проводиться только в сочетании с активной базисной терапией. С целью купирования синовита и болевого синдрома НПВП рекомендуется применять в наименьших эффективных дозах, особенно пациентам с высоким риском кардиоваскулярных осложнений. Одним из сравнительно новых НПВП является Аэртал (ацеклофенак), обладающий высокой анальгетической и противовоспалительной активностью. В ряде клинических исследований продемонстрирована высокая клиническая эффективность ацеклофенака, сопоставимая с таковой диклофенака, теноксикама, индометацина и кетопрофена. По переносимости и безопасности ацеклофенак превосходит данные НПВП. При назначении ацеклофенака частота развития побочных реакций была значительно ниже (р < 0,001) [19]. Терапевтическая доза Аэртала составляет 200 мг/сут, поддерживающая – 100 мг/сут.
Базисные противовоспалительные препараты (БПВП)
Доказано, что адекватная “базисная” терапия на ранней стадии РА позволяет предотвращать структурные повреждения, что способствует сохранению функциональной активности пациентов и улучшает отдаленный прогноз [20]. БПВП необходимо назначать не позднее 3 месяцев от начала РА с быстрой эскалацией дозы для достижения оптимального эффекта (DAS < 2,4) с последующей заменой препарата в течение 2–4 месяцев при его неэффективности [1]. Терапию БПВП следует продолжать даже при снижении активности заболевания и достижении ремиссии. На фоне применения БПВП оценивают динамику активности заболевания по индексу DAS, что помогает индивидуализировать подбор базисной терапии и существенно повысить ее эффективность.
К БПВП первого ряда отнесены метотрексат (МТ), лефлуномид и сульфасалазин (табл. 3), т. к. доказана их эффективность в отношении предотвращения деструктивных изменений суставов (уровень доказательности А). Препараты “второй линии” – гидроксихлорохин, препараты золота и др. – применяются при неэффективности препаратов первого ряда либо в комбинации с ними. Назначаются они редко в связи с высокой токсичностью и отсутствием достоверных данных о влиянии на прогрессирование заболевания.
Таблица 3.БПВП, используемые для лечения РА.
Основные стратегии применения БПВП при раннем РА [21]:
Монотерапия МТ c последующей заменой на другие БПВП (лефлуномид, сульфасалазин) в случае неэффективности или плохой переносимости.
Комбинированная базисная терапия, в т. ч. в сочетании с высокой дозой ГКС. Используются комбинации БПВП как первого, так и второго ряда. Например, МТ + сульфасалазин или МТ + гидроксихлорохин и т. д.
Комбинированная терапия синтетическими БПВП и генно-инженерными биологическими препаратами (ГИБП), в первую очередь с ингибиторами фактора некроза опухоли α [ФНО-α]). Например, МТ 25 мг/нед + инфликсимаб 3 мг/кг массы тела.
Метотрексат
МТ – “золотой стандарт” терапии активного РА. По сравнению с другими БПВП обладает наилучшим соотношением “эффективность/токсичность”. При необходимости применения МТ в дозе свыше 7,5 мг/нед рекомендуется использовать парентеральный путь введения (внутримышечный или подкожный). Канадские рекомендации (2010) по использованию МТ при РА с учетом лекарственных взаимодействий, прогностических факторов ответа на терапию, возможных побочных эффектов представлены в табл. 4. С целью минимизации побочных явлений рекомендуется использование фолиевой кислоты 1–5 мг/cут, исключая дни приема МТ.
Таблица 4.Канадские рекомендации по использованию метотрексата при РА [22].
Поскольку монотерапия БПВП не всегда позволяет эффективно контролировать деструкцию суставов и достигать развития ремиссии заболевания, в ряде случаев оправданно применение комбинированной терапии.
Существует две ее схемы:
- “step-up”-стратегия – дополнительное назначение одного или нескольких БПВП в случае неэффективности монотерапии;
- “step-down”-стратегия – переход с комбинированной терапии после достижения клинико-лабораторной ремиссии на монотерапию тем или иным БПВП.
Глюкокортикоиды
В низких дозах (менее 10 мг/сут) ГКС эффективно контролируют клинические проявления, связанные с воспалением суставов при раннем РА, а также потенциально могут усиливать действие БПВП [23].
Однако в связи с высоким риском развития побочных эффектов следует придерживаться следующих основных показаний к их применению:
- назначение ГКС на короткий период до начала действия БПВП (“bridge”терапия);
- подавление воспаления при обострении заболевания или развитии осложнений терапии БПВП;
- неэффективность НПВП и БПВП;
- внутрисуставное введение.
Генно-инженерные биологические препараты
Использование ГИБП позволяет максимально избирательно воздействовать на отдельные звенья иммунопатогенеза РА и способно существенно улучшать состояние больных РА, резистентных к стандартным БПВП и ГКС [13]. Установлено, что комбинация традиционных БПВП с ГИБП более эффективна, чем монотерапия. Назначение ГИБП показано при длительно сохраняющейся (более 3–6 месяцев) высокой активности РА; при высокой активности заболевания менее 3 месяца – только при наличии у больных факторов неблагоприятного прогноза [24].
Препаратами “первого ряда” среди ГИБП являются ингибиторы ФНО-α. Другие ГИБП назначаются больным РА с неадекватным ответом на блокаторы ФНО-α или при невозможности их применения (табл. 5).
Таблица 5.Биологические препараты, зарегистрированные в РФ.
Алгоритм обследования больных при лечении ГИБП [25]:
1. Перед началом лечения:
- клинические анализы крови и мочи;
- исследование крови на HBsAg и HCV-антитела;
- биохимический анализ крови с определением содержания билирубина, АЛТ, АСТ, креатинина, глюкозы;
- рентгенография органов грудной клетки в прямой и боковой проекции (флюорографическое исследование нецелесообразно);
- проба Манту (2 ТЕ), при отрицательной реакции (менее 5 мм) следует повторить пробу через 7–21 день;
- ЭКГ.
2. В процессе лечения:
- контроль эффективности проводимой терапии в соответствии с ACR20/ACR50/ACR70;
- контроль побочных реакций;
- обследование больных для исключения развития активного туберкулеза не реже 1 раза в 6 месяцев.
3. После завершения курса терапии:
- после прекращения применения ГИБП необходимо осуществлять наблюдение за больными еще в течение 6 месяцев.
Профилактика осложнений РА
При ведении больных РА большое значение приобретает профилактика возможных осложнений. На ранней стадии заболевания наиболее актуальным является развитие остеопороза (ОП), который может иметь как локальный, так и системный характер. Системный ОП, по мнению большинства исследователей, наиболее быстро прогрессирует в первые годы болезни и отражает тяжесть течения РА.
РА-ассоциированные факторы риска ОП и переломов:
- активность воспалительного процесса:
- выраженность рентгенологических изменений;
- тяжесть функциональных нарушений;
- длительность болезни;
- прием ГКС,
- высокий риск падений.
В настоящее время РА отнесен к независимым факторам риска переломов. Их частота среди больных РА в 1,5–2,5 раза выше, чем в общей популяции. Всем больным РА необходимо проведение расчета абсолютного риска переломов (FRAX-алгоритм), профилактическое назначение препаратов кальция и витамина D.
Назначение антиостеопоротической терапии без учета данных минеральной плотности костной ткани показано пациентам в возрасте 65 лет и старше, а также при наличии в анамнезе переломов при минимальной травме. Препаратами первой линии при лечении ОП у больных РА являются бисфосфонаты, обладающие антирезорбтивным действием. К их числу, в частности, относится Осталон (алендронат). Препарат следует применять по 70 мг 1 раз в неделю в течение не менее 3 лет при хорошей переносимости. Для обеспечения оптимальной всасываемости Осталон принимают утром натощак за 2 часа (не менее 30 минут) до первого приема пищи, запивая простой питьевой водой. Другие напитки (в т. ч. минеральные воды), пища, ряд лекарственных средств могут ухудшать абсорбцию алендроната. Существует также комбинированный препарат Осталон Кальций-Д, который помимо алендроната содержит 600 мг кальция и 400 МЕ витамина D3.
Привлекательность бисфосфонатов при РА заключается еще и в том, что, по данным экспериментальных исследований, они могут оказывать благоприятное влияния на течение болезни [26]. Установлено, что бисфосфонаты способны ингибировать cинтез провоспалительных цитокинов и развитие костных эрозий при РА [27]. У пациентов с ранним артритом бисфосфонаты в комбинации с МТ эффективно предотвращают развитие костной деструкции [28].

Заключение
РА является гетерогенным заболеванием, исходы которого во многом определяются своевременной диагностикой болезни и правильно выбранной тактикой лечения. Ранняя стадия РА, особенно первые 3 месяца от начала заболевания, наиболее благоприятны для проведения эффективной базисной терапии. Основой ведения больных ранним РА является тщательное мониторирование адекватности проводимого лечения (не реже 1 раза в 3 месяца) с последующей коррекцией терапии при необходимости. Алгоритм лечения больных на ранней стадии РА в обобщенном виде представлен на рисунке.
Информация об авторах:
Шостак Надежда Александровна – доктор медицинских наук, профессор, заведующая кафедра
факультетской терапии им. акад. А.И. Нестерова ГОУ ВПО РГМУ им. Н.И. Пирогова.
E-mail: shostakkaf@yandex.ru ;
Мурадянц Анаида Арсентьевна – кафедра факультетской терапии им. акад. А.И. Нестерова
ГОУ ВПО РГМУ им. Н.И. Пирогова.
E-mail: elitarsoft@list.ru


