Антибактериальные лекарственные средства (АБС) уверенно вошли в нашу клиническую практику начиная с 1940-х гг.
Однако их применение началось задолго до этого. Например, древние египтяне использовали заплесневелый хлеб в терапии инфицированных ран; в Иордании с древности применялись красные почвы для лечения кожных инфекций; есть данные, подтвержденные гистологически, об использования тетрациклинов в древней популяции X-группы (350–550 гг. н.э.) из Суданской Нубии, однако доказать антибиотикоподобные свойства древних медицинских рекомендаций удалось только в последние годы. В частности, было проведено исследование иорданских красных почв и из них были выделены актиномицетные бактерии, продуцирующие актиномицин С2 и актиномицин С3, являющиеся полипептидными антибиотиками [1–3]. Эйфория первых десятилетий применения АБС сменилась настороженностью в отношении рисков развития побочных эффектов и ростом резистентности возбудителей к имеющимся в арсенале врача АБС. Однако до настоящего времени отмечаются случаи нерационального их применения: назначение без наличия показаний, «на всякий случай», нарушение схем применения, широкое назначение АБС резерва и т.п. Эта тенденция, к сожалению, достаточно сильно выражена в педиатрической и хирургической практике из-за высокой частоты развития инфекционных процессов [33].
Среди побочных эффектов, связанных с терапией АБС, одним из значимых является антибиотик-ассоциированная диарея (ААД). Согласно общепринятому определению, под ААД понимают наличие как минимум трех и более эпизодов неоформленного стула, развившихся на фоне применения антибактериальных препаратов вплоть до 4–8 недель после их отмены, если не выявлена другая причина диареи [4].
Значимость этой проблемы определяется достаточно высокой частотой развития ААД – от 5 до 39% у взрослых [5, 6] и от 11 до 40% у детей [7–9], риском развития летальных исходов и ростом резистентности Clostridium difficile-инфекции к АБС [10].
Классификация ААД включает два основных вида:
- ААД, обусловленная C. difficile-инфекцией (псевдомембранозный колит, А04.7 энтероколит, вызванный C. difficile);
- идиопатическая ААД (К52.9 – неинфекционный гастроэнтерит и колит неуточненный.
Принципиально важным для клинициста в данной классификации является то, что первая служит фактически инфекционным заболеванием, для реализации которого необходимо сочетание двух факторов – прием АБС и инфицирование C. difficile. Данный вид ААД может протекать в тяжелой форме и приводить к развитию летального исхода [10].
Идиопатическая ААД развивается на фоне приема АБС, но при этом заражения C. difficile-инфекцией нет, что нередко приводит к недооценке состояния пациента. В связи с этим для практического врача важно активно выявлять таких больных, а отсутствие маркеров C. difficile-инфекции не исключает диагноза ААД.
В патогенезе развития ААД, как идиопатической, так и вызванной C. difficile-инфекцией, можно выделить три основных механизма развития диарейного синдрома:
- Побочные эффекты АБС (аллергические, токсические, фармакологические).
- Осмотический характер диареи вследствие нарушения метаболизма желчных кислот и углеводов в кишечнике (характерная особенность цефалоспоринов).
- Дестабилизация системы микробиоценоза желудочно-кишечного тракта (ЖКТ).
Следует подчеркнуть, что развитие дестабилизационных процессов в микробиоценозе ЖКТ является наиболее значимым фактором и характеризуется изменением структуры доминирования видов нормальной микрофлоры [11], что ведет к увеличению значимости в экосистеме компонентов условно-патогенной флоры (УПФ).
В свою очередь данный процесс приводит к нарушению важных функций микробиоты, таких как обеспечение короткоцепочечными жирными кислотами (КЖК) колоноцитов и участие в метаболизме КЖК [12, 13], что усугубляет дисбиотические процессы, создавая условия для роста УПФ, например Staphylococcus aureus, а также C. difficile-инфекции [14–17].
Развитие собственно диарейного синдрома при ААД связано с нарушением трофической функции микробиоты за счет снижения продукции КЖК при ААД [13]. КЖК в норме метаболизируются колоноцитами, являясь субстратом в дыхательной цепи клетки. Их окисление обеспечивает около 60–70% потребностей в энергии энтероцитов, регулирует в клетке обмен глюкозы и пирувата. Из трех основных КЖК бутират является основным энергетическим субстратом для энтероцитов и используется в качестве источника энергии даже в присутствии конкурирующих субстратов, таких как глюкоза и глутамин. Помимо нарушения трофической функции энтероцитов снижение уровня КЖК из-за дестабилизации системы микробиоценоза приводит к нарушению водно-электролитного транспорта в кишечнике, что также является одним из звеньев патогенеза развития диарейного синдрома при ААД [15].
Риск развития ААД определяется совокупностью факторов, включающих возраст пациента, характеристики преморбидного фона, наличие коморбидных заболеваний и др. Так, проведенное в Швеции исследование 2462 пациентов, находившихся на лечении в отделениях различного профиля (инфекционных болезней, ортопедии, хирургии, гериатрии, нефрологии и внутренней медицины), показало, что самая высокая частота ААД была зарегистрирована в отделениях нефрологии и гериатрии (6,7 и 7,1% соответственно). При этом у коморбидных пациентов (сахарный диабет, злокачественные опухоли, хроническая почечная недостаточность и воспалительное заболевание кишечника), имевших два или более из данных патологий, риск развития ААД значительно возрастал. Оказывал влияние на риск развития ААД и курс АБС. Так, риск развития ААД у пациентов, получавших антибиотики в течение 3 дней, был значительно меньше, чем у пациентов, получавших их более длительно [6].
Также к факторам риска развития ААД относят возраст старше 70 лет и меньше 5 лет, продолжительность госпитализации, наличие инвазивных вмешательств (в частности, проведение эндоскопических исследований, зондовое кормление), применение антацидов [5].
Большинство авторов подчеркивают, что риск развития ААД есть при любой АБС [5, 34, 35]. В частности, показано, что терапия с цефалоспоринами, клиндамицином или пенициллинами широкого спектра действия имеет четкую связь с повышенным риском развития ААД [5], применение ампициллина обусловливает развитие ААД у 10% пациентов, а использование других антибиотиков, таких как тетрациклин, макролиды (эритромицин), нитрофурантоин, ко-тримоксазол, фторхинолоны, аминогликозиды (канамицин, гентамицин), – у 2–5% [18].
По данным В.Т. Ивашкина и соавт., развитие ААД не зависит от способа введения АБС. При пероральном приеме помимо влияния на кишечную микрофлору происходит местное воздействие их непосредственно на слизистую оболочку тонкой кишки; при парентеральном введении АБС воздействуют на микробиоценоз кишечника, выделяясь со слюной, желчью, секретами тонкой и толстой кишки. Существенно повышает риск ААД увеличение длительности антибактериальной терапии и проведение повторных ее курсов, комбинации нескольких препаратов, а также использование АБС, выводящихся с желчью [19].
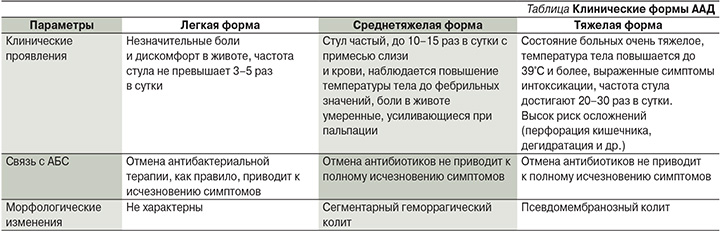
Клиническая картина ААД может варьироваться от незначительных симптомов дискомфорта со стороны органов пищеварения до тяжелых форм диареи и колита, заканчивающихся летальным исходом. Основные клинические симптомы ААД: водянистая диарея, боли в животе, которые могут носить схваткообразный характер и уменьшаться после дефекации. При тяжелых формах характерны повышение температуры тела, наличие выраженных симптомов интоксикации. В крови отмечается лейкоцитоз, что позволило некоторым авторам назвать ААД «кишечным сепсисом». В копрограмме могут определяться лейкоциты, слизь, эритроциты. Развитие эксикоза сопровождается гипопротеинемией и вторичной экссудативной энтеропатией. Клинические формы ААД представлены в таблице [20].
В настоящее время в плане профилактики и терапии ААД, по данным большинства специалистов, ведущая роль принадлежит пробиотикам, уровень рекомендаций которых с позиций доказательной медицины самый высокий – А [21]. Проведенный за рубежом мета-анализ 25 рандомизированных контролируемых исследований с участием 2810 пациентов показал, что пробиотики значительно (на 57%) снижают относительный риск ААД [17]. Эти данные были подтверждены и в других работах [21–26].
В настоящее время одним из перспективных направлений в терапевтической коррекции нарушений микробиоценоза является метабиотическая терапия. Метабиотики – структурные компоненты пробиотических микроорганизмов и/или их метаболитов, и/или сигнализирующих молекул с известной химической структурой, которая может оптимизировать главные специфические физиологические функции, метаболические и/или реакции поведения, связанные с деятельностью макроорганизма и его микрофлоры [27]. К ним относят продуцируемые штаммами нормальной микрофлоры бактериоцины и другие антимикробные молекулы, КЖК, различные другие органические кислоты, биогенные поверхностно-активные вещества, полисахариды, пептидогликаны, тейхоевые кислоты, липо- и гликопротеины, витамины, антиоксиданты, нуклеиновые кислоты, различные белки, включая ферменты и др. [28].
Данный вид терапии характеризуется высоким профилем безопасности и эффективностью, доказанной как при проведении экспериментальных исследований, так и в клинической практике [36–39]. Это обусловлено патогенетическими аспектами фармакологических эффектов метабиотиков. Метабиотики представляют собой биологически активные субстанции, фактически выполняющие роль сигнальных молекул в системе микробиоценоз–энтероциты. Они обеспечивают взаимодействие между микробиомом и клетками человека и регулируют метаболические, иммунные и нервно-рефлекторные реакции.
Входящие в состав метабиотиков КЖК (уксусная, пропионовая, масляная кислоты) остаются ведущими компонентами метабиотической терапии. Это обусловлено их влиянием на систему микробиоценоза и клетки человека. В частности, уксусная кислота оказывает антигипоксическое действие на слизистую оболочку кишечника, повышая усвоение кислорода; повышает колонизационную резистентность и секреторную активность кишечника за счет регулирования уровня pН [29]. Пропионовая кислота за счет блокировки адгезии патогенных возбудителей и УПФ реализует механизмы противоинфекционной защиты. Масляная кислота участвует в стимуляции роста и обновления клеток слизистой оболочки кишечника, обеспечивая протективные свойства муцинового слоя. Пропионовая и масляная кислоты – необходимые компоненты для синтеза некоторых гормонов и нейромедиаторов (серотонин, эндорфины) [30, 31], что нашло отражение в последних работах по влиянию микробиоты на психический статус пациентов [32].
Лекарственным средством, имеющимся в арсенале практикующего врача и относящимся к метабиотикам, является Хилак форте. В его состав входит пастеризованный раствор метаболитов Lactobacillus acidophilus и Lactobacillus helveticus, Escherichia coli, Streptococcus faecalis [40]. Входящий в состав препарата комплекс метаболитов является результатом жизнедеятельности микроорганизмов с различным типом метаболизма. Например, L. acidophilus, L. helveticus и S. faecalis характеризуются сахаролитическим типом обмена веществ, Е. coli – протеолитическим. Данный факт позволяет наиболее полно реализовывать терапевтические эффекты препарата на микробиоценоз ЖКТ за счет комплексного регулирующего действия. Это позволяет рекомендовать Хилак форте пациентам с установленными нарушениями микробиоценоза тонкого и толстого кишечника при ААД на фоне антибактериальной терапии. Схема терапии включает прием препарата внутрь до или во время приема пищи с небольшим количеством жидкости (исключая молоко) 3 раза в сутки, взрослым – по 40–60 капель на прием; детям – по 20–40 капель на прием; младенцам – по 15–30 капель на прием [40].
В заключение хотелось бы сказать, что использование АБС в клинической практике должно быть рациональным, а для предотвращения развития дестабилизирующих процессов со стороны микробиоценоза ЖКТ на фоне антибактериальной терапии наиболее целесообразно использовать современные способы подхода к терапии, в частности метабиотическую терапию.



