Стабильная стенокардия является широко распространенной патологией, сопровождающейся высокой заболеваемостью и смертностью, особенно при недостаточной эффективности лечения [1]. Предотвращение стенокардии/ишемии миокарда позволит улучшить качество жизни пациентов со стабильной ишемической болезнью сердца (ИБС) и, вероятно, продлить их жизнь [2, 3]. Бета-адреноблокаторы, блокаторы кальциевых каналов и нитраты называют традиционными или гемодинамическими антиангинальными средствами, которые служат основой рекомендованной медикаментозной терапии [4]. Однако увеличение их дозы сопровождается ухудшением переносимости препаратов, особенно в пожилом и старческом возрасте.
В таких случаях, а также при невозможности проведения чрескожной или хирургической реваскуляризации миокарда способны оказаться полезными антиангинальные препараты второй линии [5].
У больных ИБС пожилого и старческого возраста назначение β-адреноблокаторов в дозах, обеспечивающих достижение целевой частоты сердечных сокращений (ЧСС), часто приводит к развитию атриовентрикулярной блокады и других побочных эффектов. Добавление ивабрадина к сниженной дозе β-адреноблокатора более безопасно и достаточно эффективно, но может не устранять стенокардию [6]. Для дальнейшего повышения результативности антиангинальной терапии (ААТ) возможно рассмотрение назначения препаратов, не влияющих на атриовентрикулярую проводимость, уровень артериального давления, автоматизм синусового узла (триметазидин, ранолазин). Однако крупных рандомизированных исследований такого лечения не проводилось.
Цель исследования – сравнение эффективности и безопасности ААТ у пациентов с ИБС пожилого и старческого возраста сочетаниями бисопролола, ивабрадина и триметазидина или ранолазина.
Материал и методы
В исследовании участвовали 107 больных ИБС и стенокардией напряжения II/III функционального класса в возрасте от 60 до 79 лет, диагноз которой устанавливали в соответствии с рекомендациями Всероссийского научного общества кардиологов (2008). В работу включали пациентов с синусовым ритмом частотой ≥70 ударов в минуту в покое, которые не могли принимать назначавшийся им β-адреноблокатор бисопролол в дозе выше 1,25–2,5 мг/сут, чаще – из-за развития атриовентрикулярной блокады II степени или артериальной гипотензии. Критериями исключения также являлись тяжелое сердечно-сосудистое заболевание кроме ИБС; стеноз левой коронарной артерии, стенокардия покоя, нестабильная стенокардия, микрососудистая стенокардия; хроническая сердечная недостаточность III/IV функционального класса; артериальная гипотензия с симптомами или неконтролируемая артериальная гипертензия 3-й степени; фибрилляция или трепетание предсердий; имплантированные электрокардиостимулятор или дефибриллятор; невозможность выполнять или интерпретировать результаты теста с физической нагрузкой (ТФН; физическая недееспособность, перемежающаяся хромота, синдром Вольфа–Паркинсона–Уайта, полная блокада левой ножки пучка Гиса, выраженная гипертрофия левого желудочка); значительное нарушение функции печени или почек; анемия; заболевания щитовидной железы с необходимостью их фармакотерапии; сахарный диабет, требующий лечения инсулином; другие заболевания, способные ухудшить прогноз; непереносимость препаратов, запланированных для применения в исследовании.
Для достижения ЧСС в покое 55–60 ударов в минуту у всех пациентов в дополнение к бисопрололу (Конкор Кор; «Takeda», Япония) применяли ивабрадин (Кораксан; «Servier», Франция), титруя его дозу от 2,5 до 7,5 мг 2 раза в сутки. При сохранении в течение месяца стенокардии или безболевой ишемии миокарда по данным клинического наблюдения и суточного холтеровского мониторирования электрокардиограммы пациентов рандомизировали методом случайных чисел для дополнительного назначения триметазидина МВ (Предуктал МВ; «Servier», Франция) по 35 мг 2 раза в сутки (n=54) или ранолазина (Ранекса; «Berlin Chemie», Германия) по 500 мг 2 раза в сутки (n=53).
Комплексное обследование больных проведено перед началом приема тройных комбинаций антиангинальных препаратов (на фоне приема бисопролола и подобранной дозы ивабрадина) и через 6 месяцев непрерывной терапии; кроме общеклинического и лабораторных методов включило стандартную электрокардиографию в 12 отведениях, суточное холтеровское мониторирование ЭКГ с оценкой продолжительности безболевой депрессии сегмента ST, тредмил-тест с использованием модифицированного протокола Bruce, эхокардиографию в М- и В-режиме, импульсно-волновую, в т.ч. тканевую, допплерографию [7, 8], фотоплетизмографию с помощью аппарата Ангиоскан-01 («Ангиоскан», Россия), определив сдвиг фаз при окклюзионной пробе и индекс жесткости крупных артерий; оценку качества жизни с помощью Сиэтловского опросника (Seattle Angina Questionnaire).

Эффективность ААТ оценивали, сопоставив в динамике общую продолжительность нагрузки по результатам ТФН, проводившегося утром примерно в одно время. В день выполнения ТФН больные не принимали утренней дозы триметазидина или ранолазина, чтобы оценить эффективность препаратов через 12 часов после последнего вечернего приема. Нитраты короткого действия могли применяться по мере необходимости, но не менее чем за 2 часа перед ТФН. Смещения сегмента ST измеряли через 0,08 сек. после точки J в трех последовательных комплексах QRS с горизонтальной изоэлектрической линией. Если исходно отмечалась депрессия сегмента ST (максимально допустимая – на ≤0,5 мм), изменения рассчитывали от уровня в состоянии покоя до уровня во время физической нагрузки. Если в покое имелся подъем сегмента ST, депрессию ST во время нагрузки рассчитывали от изоэлектрической линии электрокардиограммы. За время до появления депрессии сегмента ST принимали длительность нагрузки до депрессии ST на 1 мм в случае изоэлектрического или повышенного сегмента ST в покое или до депрессии еще на 1 мм по сравнению с исходным положением у пациентов с депрессией ST в состоянии покоя. Если во время исследования лекарственного лечения депрессия сегмента ST на 1 мм или стенокардия не возникали в течение ТФН, в качестве времени до депрессии сегмента ST на 1 мм и времени начала стенокардии использовалась общая продолжительность нагрузки. К причинам прекращения ТФН следует отнести ограничивающую стенокардию, одышку или крайнюю усталость.
Препараты, способные помешать естественному течению стенокардии или интерпретации изменений сегмента ST (нитраты длительного действия, антагонисты кальция, другие β-адреноблокаторы, блокаторы калиевых каналов, молсидомин, антиаритмические средства, сердечные гликозиды), не применялись во время исследования. Также не допускался прием лекарственных препаратов с известным клинически значимым взаимодействием с бисопрололом, ивабрадином, триметазидином, ранолазином (согласно инструкциям к ним).
Пациенты регистрировали в специальном дневнике возникновение приступов стенокардии и потребление нитратов короткого действия, изменения частоты которых рассматривались как проявление антиангинального эффекта терапии.
В статистическую обработку включали результаты обследования пациентов, постоянно принимавших назначенные антиангинальные препараты, используя пакет прикладных программ «STATISTICA 6.1» (StatSoft Inc, США). Образовавшиеся группы проверялись на нормальность распределения с помощью одностороннего теста Колмогорова–Смирнова. Все данные представлены в виде средней арифметической (М), стандартного отклонения средней арифметической (SD). Достоверность различий показателей по количественным признакам определяли по критерию t-Стьюдента, по качественным – с использованием критерия χ2, признавая их статистически значимыми при р<0,05.
Результаты исследования
Сформировавшиеся две группы пациентов оказались хорошо сбалансированными по ряду показателей (табл. 1).
Средние дозы ивабрадина, обеспечивавшие достижение целевой ЧСС в покое при их добавлении к низкой дозе бисопролола, составляли 6,2±1,8 и 6,0±2,2 мг в группах триметазидина и ивабрадина соответственно.
Через 6 месяцев тройной ААТ отмечено значительное улучшение переносимости физической нагрузки пациентами обеих групп. Так, общая продолжительность нагрузки увеличилась на 65,4±102,7 с в группе триметазидина (р<0,001) и на 60,3±98,9 с в группе ранолазина (р<0,001), время до возникновения стенокардии – на 63,8±105,5 с (р<0,001) и 61,7±103,0 с (р<0,001), время до депрессии сегмента ST на 1 мм – на 77,0±111,8 с (р<0,001) и 74,2±108,5 с (р<0,001) соответственно (различия между группами недостоверны). Частота приступов стенокардии существенно снижалась от 2,2±3,5 до 0,8±2,4 приступа в неделю при лечении комбинацией препаратов, включившей триметазидин, и от 2,0±2,4 до 0,9±2,3 – комбинацией, включившей ранолазин (различие между группами недостоверно). При этом добавление к терапии триметазидина или ранолазина не сопровождалось существенными изменениями ЧСС в покое и артериального давления.
Изменения основных показателей суточного холтеровского мониторирования ЭКГ, эхокардиографии, фотоплетизмографии и качества жизни на фоне сопоставленных схем тройной ААТ представлены в табл. 2.
Продолжительность безболевой депрессии сегмента ST более чем на 1 мм в течение суток уменьшалась под влиянием ААТ, включившей как триметазидин, так и ранолазин, однако в значительно большей степени при первом способе терапии (р<0,001). Это преимущество триметазидина имеет практическое значение, поскольку способно оказать позитивное влияние на прогноз больных [9].
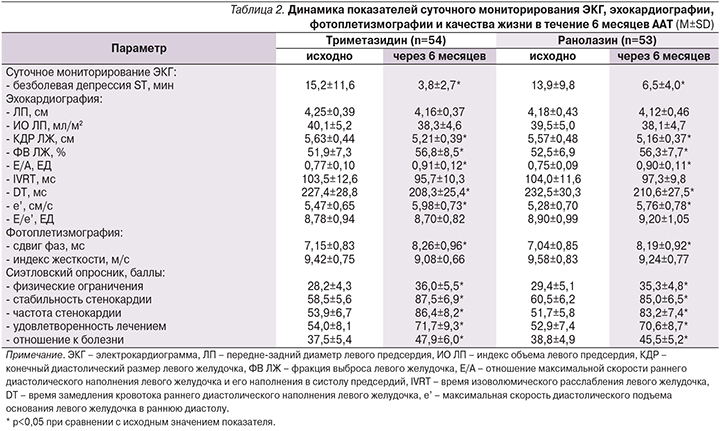
В обеих группах отмечено сопоставимое улучшение показателей систолической и диастолической функций левого желудочка, структурного и функционального состояния крупных артерий. Оба способа ААТ обеспечивали сходное статистически значимое улучшение качества жизни по всем шкалам Сиэтловского опросника.
За 6 месяцев контролируемой терапии не зарегистрировано смертельных исходов, развития острых коронарных синдромов. Зрительные симптомы (фотопсии), связанные с приемом ивабрадина, наблюдались у 2 пациентов каждой из двух групп. Лечение триметазидином сопровождалось периодическим дискомфортом со стороны желудочно-кишечного тракта (обычно ощущение изжоги) у 3 больных. Ранолазин вызывал головокружение у 3 и тошноту у 1 пациента. Ни в одном случае этот препарат не удлинял корригированный интервал QT более 450 мс.
Все побочные эффекты применявшихся лекарственных средств были легковыраженными, имели преходящий характер, не приводили к отказу от их приема.
Обсуждение
Несмотря на очевидный прогресс и широкое применение методов реваскуляризации миокарда, стенокардия не исчезла [10]. В пожилом и старческом возрасте реваскуляризация нередко оказывается невозможной, например, из-за технических проблем чрескожного коронарного вмешательства (ЧКВ), тяжелых сопутствующих заболеваний и отказа от коронарного шунтирования. Более того, ЧКВ в дополнение к оптимальной медикаментозной терапии стабильной ИБС не улучшает отдаленные исходы по сравнению с одной оптимальной медикаментозной терапией [11].
Все большее число пациентов имеют тяжелые поражения коронарных артерий с симптомами ишемии, которые не поддаются медикаментозному лечению и реваскуляризации. В таких случаях констатируют рефрактерную стенокардию [12]. Основу лечения рефрактерной стенокардии, особенно в пожилом и старческом возрасте, составляют фармакологические средства [13]. Наиболее часто в дополнение к традиционным антиангинальным препаратам назначают ивабрадин, триметазидин или ранолазин [14], что соответствует действующим рекомендациям по лечению стабильной ИБС [4]. Между тем пациент может быть преждевременно расценен как не отвечающий на лекарственную терапию до того, как были испробованы все доступные антиангинальные средства.
Доказательства улучшения исходов у больных без сердечной недостаточности/дисфункции левого желудочка при лечении ивабрадином [15], а также β-адреноблокаторами даже в первый год после инфаркта миокарда отсутствуют [16], но антиангинальный эффект этих препаратов не вызывает сомнений. В нашем исследовании пациенты пожилого и старческого возраста в каждом случае получали бисопролол в низкой дозе и ивабрадин, однако стенокардия и безболевая ишемия миокарда сохранялись, качество их жизни оставалось достаточно низким. Добавление к терапии третьего антиангинального средства, триметазидина или ранолазина существенно и в равной степени повышало толерантность больных к физической нагрузке, улучшало эхокардиографические показатели систолической и диастолической функций левого желудочка, качество жизни.
Механизм антиангинального действия триметазидина и ранолазина значительно различается. Триметазидин частично ингибирует митохондриальный фермент –длинноцепочечную 3-кетоацил коэнзим-А-тиолазу, участвующую в окислении жирных кислот, что способствует переключению с окисления жирных кислот на таковое глюкозы, требующее меньшего количества кислорода, что улучшает энергетический метаболизм в ишемизированном миокарде [17]. Триметазидин уменьшает гипоксическое повреждение кардиомиоцитов путем улучшения гомеостаза ионов Ca2+ [18], активирует АМФ-активированную протеинкиназу («сенсор энергии АТФ»), защищая миокард от повреждения при ишемии/реперфузии [19] и предупреждая апоптоз кардиомиоцитов путем увеличения экспрессии микроРНК-21 [20]. Ранолазин ингибирует поздний ток ионов Na+ внутрь кардиомиоцитов в конце реполяризации, препятствуя внутриклеточной перегрузке ионами Са2+, обусловливающей нарушение релаксации левого желудочка при ишемии/реперфузии [21]. В результате улучшения диастолического расслабления миокарда ранолазин препятствует дальнейшему ухудшению коронарного кровотока при ИБС. Кроме того, ранолазин ингибирует задержанный выходящий ток ионов K+, что сопровождается удлинением продолжительности потенциала действия желудочков (интервал QT электрокардиограммы). Антагонизм ранолазина по отношению к α1- и β1-адренорецепторам объясняет его способность снижать ЧСС при стрессе [22].
Антиангинальная эффективность триметазидина не уступает таковой традиционных средств лечения стабильной стенокардии [23]. Добавление триметазидина к стандартной терапии больных с сочетанием ИБС и хронической сердечной недостаточности в еще большей степени повышало толерантность к физической нагрузке [24], сопровождалось снижением частоты смертельного исхода от всех причин на 71% (p<0,00001), сердечно-сосудистых событий и госпитализаций – на 58% (р<0,00001) [25]. Ранолазин в качестве дополнения к традиционной ААТ превосходил плацебо в способности предупреждать приступы стабильной стенокардии, но при монотерапии оказывал неопределенное влияние на частоту эпизодов стенокардии, риск сердечно-сосудистой смерти, смертности от всех причин и нефатального инфаркта миокарда [26]. Недавно A.A. Bavry и соавт. [27] сообщили об отсутствии уменьшения симптомов стенокардии через 16 недель лечения ранолазином пациентов со стабильной ИБС и документированной ишемией миокарда.
В исследовании RIVER-PCI у 2604 больных стабильной стенокардией с неполной реваскуляризацией (один или несколько стенозов на ≥50% в коронарных артериях диаметром ≥2 мм) после ЧКВ ранолазин не уменьшал суммарное количество событий первичной конечной точки – время до первого появления ишемии, потребовавшей реваскуляризации или госпитализации по поводу ишемии без реваскуляризации (р=0,48) [28]. В субанализе этого исследования пациентов с сахарным диабетом (n=961) ранолазин снижал уровень гемоглобина А1с, но не уменьшал тяжесть стенокардии через 12 месяцев терапии [29]. Ранее X. Xu и соавт. применяли триметазидин после ЧКВ у больных с сочетанием многососудистой ИБС и сахарного диабета [30]. Через 2 года наблюдения в группе лечения триметазидином (n=255) по сравнению с контролем (n=255) наблюдалось значительное уменьшение частоты (р=0,024) и тяжести стенокардии, безболевой ишемии миокарда (р=0,009); существенно большее число пациентов было свободно от стенокардии (р=0,011).
Известно, что эндотелиальная дисфункция является независимым предиктором прогрессирования атеросклероза и сердечно-сосудистых осложнений у больных ИБС. Согласно данным фотоплетизмографии, в динамике у наших пациентов отмечено сопоставимое улучшение структурно-функционального состояния крупных артерий при лечении обеими тройными комбинациями антиангинальных препаратов. Эти данные согласуются с сообщением A. Rehberger-Likozar и M. Šebeštjen [31] о том, что лечение триметазидином или ранолазином в равной мере улучшает вызванную потоком и индуцированную нитроглицерином дилатацию плечевой артерии у пациентов с ИБС.
Проблема отсутствия специальных рекомендаций по лечению рефрактерной стенокардии очевидна. Основное внимание клиницистов нацелено на уменьшение симптомов и улучшение качества жизни таких пациентов, т.к. средства улучшения долгосрочного прогноза еще не известны [32]. Согласно результатам нашей работы, комбинации низкой дозы β-адреноблокатора с ивабрадином и триметазидином или ранолазином могут применяться для лечения рефрактерной стабильной стенокардии у пациентов пожилого и старческого возраста. Триметазидин превосходил ранолазин в способности уменьшать продолжительность безболевой депрессии сегмента ST по данным холтеровского мониторирования ЭКГ. Этот факт заслуживает внимания, поскольку установлено, что ишемия миокарда, а не cтенокардия является ключевым фактором, влияющим на прогноз ИБС [33]. Необходимы крупные рандомизированные клинические исследования для определения роли комбинаций антиангинальных препаратов при рефрактерной стенокардии.


