Лечение злокачественных глиом является одной из самых сложных проблем в нейроонкологии. Это мультидисциплинарная проблема, в решении которой принимают участие нейрохирурги, лучевые терапевты, химиотерапевты и патоморфологи. Среди всех злокачественных глиом особое место занимают глиобластомы, характеризующиеся агрессивностью течения и резистентностью к стандартной терапии. Наиболее значительных успехов в лечении этих опухолей за последние 10 лет удалось добиться за счет включения в схему лечения алкилирующего препарата темозоломид.
В 2004 г. в исследовании III фазы, проведенном Европейской организацией по изучению и лечению рака (EORTC) и Национальным институтом рака Канады (NCIC), получены результаты, указывающие на увеличение медианы выживаемости и 2-летней выживаемости среди больных глиобластомой, которые получали лучевую терапию и одновременно, а затем и адъювантно принимали темозоломид [1]. Преимущество химиолучевой терапии отмечено во всех клинических прогностических подгруппах, включая больных 60–70 лет. Наиболее значимым фактором, позволяющим предсказать результат лечения и эффективность темозоломида, было метилирование промотора MGMT. Определение метилирования гена MGMT позволяет выделить подгруппу больных, которым применение темозоломида с наибольшей вероятностью принесет клиническую пользу [2, 3]. С момента получения результатов исследования комбинированный режим, включающий проведение лучевой терапии с ежедневным приемом темозоломида (75 мг/м²/сут внутрь 1–42-й дни в период проведения лучевой терапии) с последующими 6 циклами темозоломида в адъювантном режиме (150–200 мг/м2/сут внутрь 1–5-й дни каждые 28 дней), стал стандартом лечения злокачественных глиом.
Вместе с тем не всем пациентам можно назначать пероральную форму препарата. К этой группе относятся пациенты с нарушением функции глотания вследствие повышения внутричерепного давления или поражения ствола головного мозга; пациенты, не способные принимать препараты
внутрь из-за нарушения проходимости желудочно-кишечного тракта, неукротимой тошноты и рвоты или другой сопутствующей патологии, нарушающей системное всасывание лекарственного средства, а также дети. Решить эту проблему и расширить возможности применения темозоломида удалось благодаря разработке и внедрению в клиническую практику внутривенной формы препарата.
Результаты ряда исследований, проведенных на приматах (кроме человекообразных) [4], собаках и крысах [5], показали одинаковые профили фармакокинетики (ФК) темозоломида в плазме после приема внутрь или внутривенного введения. На основании
этих данных было проведено пилотное клиническое исследование, сравнившее профили ФК темозоломида при пероральном приеме и внутривенном введении в течение 60 минут в эквивалентной дозе. По результатам исследования, площадь под кривой концентрации (AUC) была одинаковой при
пероральном приеме и внутривенном введении темозоломида. Однако отношение (вну тривенная: пероральная форма) максимальных концентраций препарата после введения (Cmax) не соответствовало критериям эквивалентности доз. Скорость внутривенной инфузии была основным параметром, требовавшим оптимизации, чтобы максимально соответствовать кинетике всасывания из желудочно-кишечного тракта и достигать значе ний Cmax, как при эквивалентном пероральном приеме. Проведено имитационное моделирование методом Монте-Карло для оценки результатов перекрестных исследований применения препарата в эквивалентных дозах с использованием популяционной ФК-модели, полученной в предыдущем популяционном исследовании пероральной формы темозоломида [6], показавшее, что при внутривенной инфузии в течение 90 минут можно добиться равноценности действия относительно Cmax.
Заслуживают внимания результаты многоцентрового открытого рандомизированного перекрестного исследования по сравнению ФК внутривенной и пероральной форм темозоломида [7]. Основной целью исследования была оценка сопоставимого системного действия (Cmax и AUC) темозоломида и его активного метаболита MTIC при внутривенном введении и пероральном приеме. Были рандомизированы 22 пациента, получавших терапию темо золомидом в течение 5 дней (пероральный прием препарата один раз в день в течение 4 дней и однократное внутривенное введение темозоломида на 3-й или 4-й день). Одиннадцати пациентам препарат вводился внутривенно на 3-й день и еще 11 пациентам – на 4-й день. В этом исследовании для внутривенного введения была выбрана доза темозоломида 150 мг/м², утвержденная для первого цикла лечения пациентов с рецидивами глиом. Препарат вводился внутривенно в течение 90 минут на 3-й или 4-й день в середине 5-дневного цикла лечения. Результаты этого исследования показали, что внутривенное введение в течение 90 минут и пероральный прием темозоломида в эквивалентной дозе соответствовали критериям эквивалентности доз, исходя из отношения средних величин AUC и Cmax для темозоломида и MTIC [7]. Авторы исследования отметили хорошую переносимость внутривенной формы темозоломида. Возникшие во время применения препарата нежелательные явления соответствовали ранее зарегистрированным у пациентов с рецидивирующей глиомой, принимавших пероральную форму темозоломида, за исключением местных реакций при внутривенном введении. Реакции в
месте инъекции были в основном слабовыраженными и преходящими [7]. Полученные результаты позволили рекомендовать внутривенное введение темозоломида по показаниям и схемам, утвержденным для пероральной формы препарата.
В России темозоломид зарегистрирован для применения в комплексной терапии злокачественных глиом в 2001 г. Накопленный опыт показал эффективность и хорошую переносимость препарата в форме капсул для перорального приема. В 2012 г. зарегистрирована новая лекарственная форма темозоломида – лиофилизат для приготовления раствора для внутривенной инфузии. Присутствие в клинической практике двух лекарственных форм послужило основанием для сопоставления переносимости и оценки побочных эффектов темозоломида при различных путях введения.
Цель исследования заключалась в оценке переносимости и нежелательных эффектов темозоломида при пероральном приеме и внутривенном введении для оптимизации выбора лекарственной формы препарата и улучшения качества жизни в процессе лечения больных со злокачественными глиомами.
Материал и методы
В радиологическом отделении Челябинского областного клинического онкологического диспансера с
августа 2012 по январь 2013 г. темозоломид в форме лиофилизата получили 16 больных со злокачественными глиомами в возрасте от 30 до 66 лет; характеристика представлена в табл. 1.
Все больные были оперированы и имели морфологическую верификацию. Преобладали больные с первичной глиобластомой (n = 11). У 5 больных был рецидив анапластической астроцитомы.
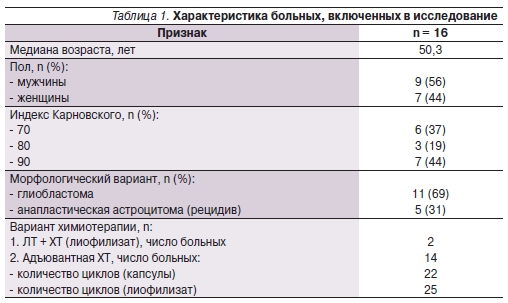
Двум больным темозоломид вводился внутривенно за час до сеанса облучения в дозе 75 мг/м2 в течение 40 дней курса лучевой терапии (ЛТ). Назначение внутривенной инфузии было связано с проблемами проглатывания капсул в одном случае и наличием в анамнезе язвенной болезни желудка в другом. ЛТ проводилась на ускорительном комплексе “Elekta Synergy” с 3-D-планированием до суммарной дозы 60 Гр, подводимых за 30 фракций в течение 6 недель.
Четырнадцать больных получали последовательно темозоломид перорально (22 цикла) и внутривенно
(25 циклов) в процессе адъювантной химиотерапии (АХТ) в дозе 150–200 мг/м2 5 дней 28-дневного цикла. Непосредственно перед инфузией лиофилизат во флаконе разводили в 41 мл воды для инъекций. Приготовленный раствор, содержащий 2,5 мг темозоломида в 1 мл, вводили через центральный или периферический венозный катетер в течение 90 минут.
Результаты
Для реализации цели исследования были поставлены следующие задачи:
1. Оценить характер и тяжесть нежелательных эффектов, связанных с применением темозоломида перорально и внутривенно.
2. Оценить преимущества каждой лекарственной формы.
3. Определить группу больных с показаниями к назначению внутривенной формы темозоломида.
Тяжесть нежелательных явлений оценивалась по критериям Common Terminology Criteria for Adverse Events (CTCAE), ver. 4.0.
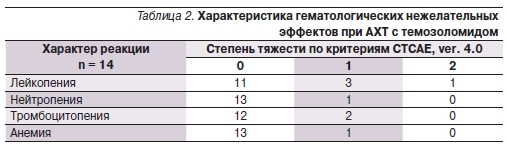
Гематологические показатели оценивались на 21-й и 28-й дни цикла. Гематологическая токсичность темозоломида оказалась невысокой (табл. 2). При назначении темозоломида одновременно с ЛТ на протяжении всего курса лечения гематологических токсических реакций не отмечено. Из 14
больных, получавших АХТ, гематологическая токсичность имела место в единичных случаях. Анемия и тромбоцитопения 1-й степени тяжести, лейкопения 1–2-й степеней, нейтропения 1-й степени по критериям CTCAE, ver. 4.0, развивались после 3–4 циклов независимо от способа введения препарата.
Среди негематологических нежелательных эффектов заслуживают внимания реакции со стороны пищеварительной системы (табл. 3). Тошнота 1–2-й степеней тяжести отмечена всеми больными (n = 14), получавшими капсулы темозоломида в течение всех 22 циклов АХТ. Рвота 1-й степени тяжести была у 12 из 14 больных при проведении 16 из 22 циклов АХТ. Как правило, рвота возникала в первые
1–2 дня приема капсул темозоломида в дозе 200 мг/м2. Стандартная антиэметическая терапия включала назначение дексаметазона в дозе до 8,0 мг в сутки и метоклопрамида в дозе 2,0 мл в/м 3–4 раза в день. Диспепсия 1-й степени тяжести отмечена у 6 из 14 больных в процессе 10 из 22 циклов
АХТ с применением капсул темозоломида. Все больные с диспепсией имели в анамнезе хронические
заболевания желудочно-кишечного тракта.
Таблица 3. Характеристика негематологических нежелательных эффектов при АХТ с темозоломидом.
При внутривенном введении темозоломида тошнота 1-й степени была у 2 из 14 больных во время проведения 3 из 25 циклов АХТ.
Появление слабости 1-й степени тяжести отметили 7 женщин и 1 мужчина в течение первых двух недель после завершения 18 и 12 циклов с применением капсул и лиофилизата темозоломида соответственно.
Не отмечено каких либо нежелательных эффектов при внутривенном введении темозоломида в дозе
75 мг/м2 ежедневно одновременно с ЛТ. Местных реакций, связанных с внутривенным введением препарата в дозах 75 и 150–200 мг/м2, также не зафиксировано.
Обсуждение
До настоящего времени темозоломид остается наиболее эффективным препаратом в лечении злокачественных глиом. По результатам рандомизированного исследования III фазы EORTC-NCIC, представленным в работе R. Stupp и соавт. [3], медиана выживаемости больных с глиобластомами, получавших комплексную терапию с темозоломидом, увеличилась на 2,5 месяца и составила 14,6 месяца (2-летняя выживаемаемость составила 27,2 % в группе комбинированной терапии по сравнению с 10,9 % в группе ЛТ).
Анализ 5-летних данных показал, что преимущества в выживаемости в группе химиолучевой терапии сохранялись до 5 лет и достигали уровня статистической значимости даже среди больных с плохим прогнозом (возраст старше 60 лет, класс V). Пятилетняя выживаемость в общей группе комбинированной терапии составила 9,8 % по сравнению с 1,9 % в группе ЛТ. В группе благоприятного прогноза (возраст моложе 50 лет, соматический статус 0–1 и полная резекция опухоли) 5-летняя выживаемость составила 28,4 % [3].
Тем не менее прогноз при данной морфологической форме остается неблагоприятным. Низкая продолжительность жизни при длительности комплексной терапии около 9–10 месяцев заставляет уделять особое внимание качеству жизни не только после завершения, но и в процессе лечения.
Токсичность и безопасность внутривенной формы темозоломида оценивались в исследовании
K. Motomura и соавт. [8]. Восемь пациентов со злокачественными глиомами в возрасте от 3 до 40 лет получали внутривенную форму темозоломида по стандартной схеме R. Stupp. Поводом к назначению внутривенной формы служило наличие дисфагии у больных с опухолью ствола головного мозга
или затрудненное проглатывание крупных капсул детьми. Токсические реакции при внутривенном введении темозоломида не отличались от наблюдаемых при пероральном его приеме в других исследованиях. Сопоставимой оказалась и биоэквивалентность обеих форм препарата [8].
В нашем исследовании в процессе проведения АХТ у большинства больных, принимавших капсулы
темозоломида в дозе 150–200 мг/м2, возникали диспепсические реакции. Внутривенное введение препарата оказалось менее токсичным. Все больные, получавшие темозоломид в обеих лекарственных формах, отметили лучшую переносимость внутривенной инфузии по сравнению с приемом капсул.
Полученные результаты позволяют рекомендовать внутривенное введение темозоломида в следующих ситуациях: при нарушении глотания вследствие неврологического дефицита, затрудненном проглатывании капсул, тяжелой тошноте и рвоте при предшествующем приеме капсул, при хронических заболеваниях органов желудочно-кишечного тракта, а также у детей. Ввиду хорошей переносимости возможно проведение инфузий в условиях дневного стационара или амбулаторно.
Преимущества темозоломида в форме капсул реализуются наиболее полно в процессе лучевой терапии в связи с хорошей переносимостью препарата в дозе 75 мг/м2 и необходимостью ежедневного его приема перед сеансом облучения с целью радиосенсибилизации. Однако для больных с нарушением глотания возможно только внутривенное введение темозоломида. В этих случаях необходимо предусмотреть установку центрального венозного катетера на весь период лечения.
Таким образом, полученные нами результаты по сравнению внутривенного и перорального введения темозоломида в отношении нежелательных явлений свидетельствуют о невысокой токсичности препарата. Наличие двух лекарственных форм расширяет возможности применения темозоломида
у больных со злокачественными глиомами.


