Костная система представляет собой динамическую систему, в которой постоянно происходит процесс обновления (ремоделирования), включающий резорбцию и формирование костной ткани. Данный процесс зависит от баланса между клетками костной системы (остеобластами, остеоцитами, остеокластами) и регуляторами костного обмена (цитокинами и факторами роста). При нарушении этого баланса может происходить развитие патологических состояний, одним из которых является остеопороз.
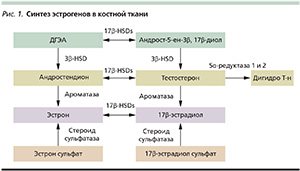
Главный показатель здоровья кости – ее плотность. Она поддерживается четким балансом между двумя процессами: образованием кости и резорбцией. Эти процессы происходят в результате активности основных клеток костной ткани: остеобластов («клеток-строителей»), остеокластов («клеток-разрушителей»), остеоцитов («клеток-интеграторов»), а также ряда клеток костного мозга. Остеоциты составляют более 90–95 % всех клеток костной ткани, тогда как остеобласты – 4–6 %, а остеокласты – 1–2 %. Остеобласты происходят из полипотентных мезенхимальных стволовых клеток, остеокласты – из мононуклеарных предшественников моноцит-макрофагальной линии [1]. Все эти клетки связаны между собой и костным мозгом благодаря дендритическим отросткам остеоцитов. Остеоциты играют важную роль в регуляции костного обмена в ответ на изменение механической нагрузки, а также регулируют фосфатный гомеостаз и могут функционировать как эндокринная железа, вырабатывая склеростин и RANKL (лиганд-рецептор, активирующий ядерный фактор NF-κB), интегрируя деятельность всех костных клеток [2]. Модулирование функций данных клеток возможно через действие на них системных (гормонов) и локальных факторов (цитокинов, факторов роста). В костной ткани существуют также необходимые ферменты для синтеза эстрогенов из андрогенов (рис. 1).
 Для полноценной функции костной ткани в различные периоды жизни женщины крайне важна пиковая костная масса (ПКМ), которая достигается в пубертатном периоде. Значимое число эндогенных (генетических, гендерных, гормональных) и экзогенных факторов (питание, физическая активность, ятрогенные состояния) влияют на достижение надлежащей ПКМ. Около 40 % ПКМ достигается в период пубертата. Крайне важны также нормальный гормональный статус, своевременное менархе, регулярный менструальный цикл. Свыше 90 % ПКМ достигается девочками к 18 годам и мальчиками – к 20. ПКМ у юношей на 30 % больше, чем у молодых женщин, поэтому женщины более уязвимы, чем мужчины, в отношении развития остеопении и остеопороза. Финальное образование ПКМ происходит приблизительно к 25–30 годам [3].
Для полноценной функции костной ткани в различные периоды жизни женщины крайне важна пиковая костная масса (ПКМ), которая достигается в пубертатном периоде. Значимое число эндогенных (генетических, гендерных, гормональных) и экзогенных факторов (питание, физическая активность, ятрогенные состояния) влияют на достижение надлежащей ПКМ. Около 40 % ПКМ достигается в период пубертата. Крайне важны также нормальный гормональный статус, своевременное менархе, регулярный менструальный цикл. Свыше 90 % ПКМ достигается девочками к 18 годам и мальчиками – к 20. ПКМ у юношей на 30 % больше, чем у молодых женщин, поэтому женщины более уязвимы, чем мужчины, в отношении развития остеопении и остеопороза. Финальное образование ПКМ происходит приблизительно к 25–30 годам [3].
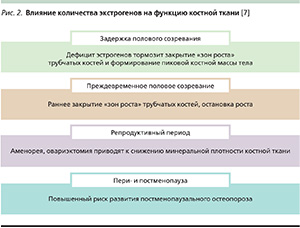
Таким образом, как дефицит, так и гиперпродукция эстрогенов отражается на функции костной ткани (рис. 2). У мужчин при дефиците ароматазы и, соответственно, торможении синтезы эстрогенов из андрогенов также может отмечаться задержка закрытия зон роста и формирования ПКМ.
К системным гормонам, влияющим на костное ремоделирование, относятся эстрогены, прогестерон, андрогены, кальцитонин, тироксин, гормон роста, паратгормон, кортикостероиды, 1,25(ОН)D3.
Эстрогены играют важную роль в процессах роста скелета и костного гомеостаза как у женщин, так и у мужчин. Они являются мощными антирезорбтивными агентами, способными контролировать экспрессию ряда цитокинов, участвующих в процессах резорбции костной ткани, и предотвращать развитие остеопороза.
В 1988 г. выявлена экспрессия эстрогеновых рецепторов (ЭР) остеобластами, остеоцитами и остеокластами. Различают ЭР-α и ЭР-β. Эти рецепторы также экспрессируются в стромальных клетках костного мозга, Т-, В-клетках и во многих других клетках костного мозга. Существует прямое геномное действие эстрогенов на костные клетки через регуляцию экспрессии генов ряда цитокинов. Негеномное действие через мембранные формы ЭР; регуляторные эффекты на иммунную систему и оксидативный стресс.
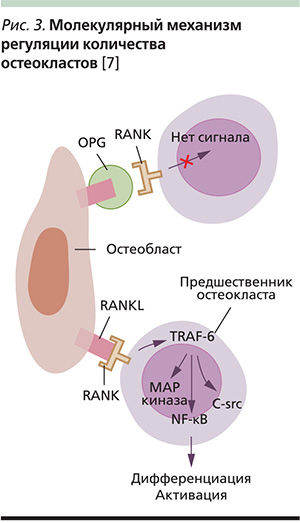
Ключевыми молекулами, участвующими в процессах образования и резорбции кости, являются цитокины – представители двух больших суперсемейств – лигандов, родственных фактору некроза опухолей α (ФНО-α), и их рецепторов, к которым относятся: белок RANK (receptor activator of nuclear factor) – рецептор, активирующий ядерный фактор NF-κB, и его белковый лиганд RANKL (также называемый «лиганд остеопротегерина», или «фактор дифференцировки остеокластов»), а также молекула остеопротегерина (OPG – «osteoprotegerin») – цитокина, родственного RANK [6].
 Если взаимодействие белков RANK и RANKL произошло в синергизме с макрофаг-колониестимулирующим фактором (M-CSF – Macrophage colony-stimulating factor), в клетке запускается два механизма. Один из них через фактор NF-κВ и MAP-киназу направлен на дифференцировку, другой с помощью киназы src предотвращает апоптоз остеокласта, что активирует процесс резорбции кости (рис. 3). Эстрогены увеличивают синтез остеопротегерина (остеобластами, стромальными клетками и другими гемопоэтическими клетками) и снижают выработку M-CSF (теми же клетками) и RANK (остеокластами и их предшественниками). Эстрогены также способны снижать количество RANKL (остеобластов, стромальных клеток и активированных Т-клеток костного мозга) непрямым способом – через воздействие на экспрессию других цитокинов или снижая чувствительность созревающих остеокластов к RANKL.
Если взаимодействие белков RANK и RANKL произошло в синергизме с макрофаг-колониестимулирующим фактором (M-CSF – Macrophage colony-stimulating factor), в клетке запускается два механизма. Один из них через фактор NF-κВ и MAP-киназу направлен на дифференцировку, другой с помощью киназы src предотвращает апоптоз остеокласта, что активирует процесс резорбции кости (рис. 3). Эстрогены увеличивают синтез остеопротегерина (остеобластами, стромальными клетками и другими гемопоэтическими клетками) и снижают выработку M-CSF (теми же клетками) и RANK (остеокластами и их предшественниками). Эстрогены также способны снижать количество RANKL (остеобластов, стромальных клеток и активированных Т-клеток костного мозга) непрямым способом – через воздействие на экспрессию других цитокинов или снижая чувствительность созревающих остеокластов к RANKL.
Ряд провоспалительных цитокинов необходим для дифференцировки и активации остеокластов. Среди них: интерлейкин-1 (ИЛ-1), ИЛ-6, ИЛ-7, ФНО-α, M-СSF, гранулоцит-макрофаг-колониестимулирующий фактор (GM-СSF – Granulocyte-macrophage colony-stimulating factor), простагландин E2 (PGE2) и др. Под их действием предшественники остеокластов превращаются в активные остеокласты. Вследствие этого усиливается резорбция костной ткани. Эстрогены подавляют выработку данных цитокинов, выступая в качестве антирезорбтивных агентов.
Напротив, эстрогены способны увеличивать синтез некоторых цитокинов, оказывающих защитное действие на плотность кости. К ним относятся трансформирующий фактор роста-α и остеопротегерин, действие которых приводит к уменьшению активности и усилению апоптоза в остеокластах.
Эстрадиол является одной из главных детерминант, обеспечивающих надлежащий костный обмен. Эстрадиол играет важную роль в следующих процессах [8–10]:
- стимуляции ростовых факторов (трансформирующего фактора рос-та β, инсулиноподобного фактора роста, морфогенетического белка кости 6);
- ингибировании продукции RANKL;
- увеличении экспрессии гена остеопротегерина – ингибитора образования остеокластов;
- снижении синтеза прорезорбтивных цитокинов (ИЛ-1, -6, ФНО-α, макрофаг-колониестимулирующего фактора);
- стимуляции экспрессии рецепторов к витамину 1,25(ОН)D3, гормону роста и прогестерону.
 В целом эстрогены вызывают активацию костноремоделирующих единиц, торможение костной резорбции и стимуляцию костеобразования [11]. Дефицит эстрогенов играет важную роль в развитии остеопороза у молодых женщин как с аменореей, так и в постменопаузе [12].
В целом эстрогены вызывают активацию костноремоделирующих единиц, торможение костной резорбции и стимуляцию костеобразования [11]. Дефицит эстрогенов играет важную роль в развитии остеопороза у молодых женщин как с аменореей, так и в постменопаузе [12].
Кроме половых гормонов, влияющих на достижение надлежащей ПКМ и костный обмен, широко обсуждается роль генетических, гендерных и экзогенных факторов (питание, физическая активность, ятрогенные состояния).
Остеопороз
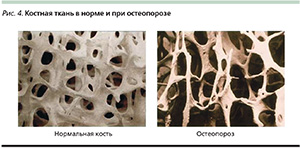
Остеопороз – это заболевание скелета, для которого характерно уменьшение костной массы, плотности костей и нарушение их архитектоники, что приводит к снижению прочности костей и, следовательно, увеличению риска переломов. Остеопороз характеризуется состоянием, при котором процесс резорбции костной ткани преобладает над процессом костеобразования (рис. 4).
При остеопорозе отсутствует ранняя специфическая клиническая картина. Проявлением остеопороза являются переломы, которые чаще наблюдаются в костях с низкой МПК (минеральной плотностью кости) и происходят при низком уровне травмы (низкотравматичных переломах). Остеопороз следует подозревать, если рост снизился более чем на 2 см за год или на 4 см в течение жизни.
Диагностика остеопороза
Для диагностики остеопороза, как правило, применяют несколько методов:
- рентгенография (информативна при потере костной массы ≥ 30 %);
- одноэнергетическая рентгеновская абсорбциометрия (ОРА);
- двухэнергетическая рентгеновская абсорбциометрия (ДЭРА), включая периферическую;
- количественная компьютерная томография (ККТ), включая периферическую;
- ультразвуковая диагностика.
ДЭРА является «золотым» стандартом неинвазивной диагностики остеопороза.
По результатам данного метода исследования выделяют следующие степени снижения МПК:
Низкая костная масса (остеопения): показатели МПК находятся в пределах 1–2,5 SD (стандартного отклонения) от среднего значения ПКМ у молодых здоровых женщин.
 Остеопороз: МПК ниже среднего значения ПКМ у молодых здоровых женщин более чем на 2,5 SD.
Остеопороз: МПК ниже среднего значения ПКМ у молодых здоровых женщин более чем на 2,5 SD.
Тяжелый (развивающийся) остеопороз: МПК ниже среднего значения ПКМ у молодых здоровых женщин более чем на 2,5 SD, имеются переломы.
Определение биохимических маркеров костного ремоделирования используется не для диагностики остеопороза, а лишь для динамического наблюдения за эффективностью терапии. Маркеры резорбции кости: гидроксипролин, пиридинолин (Пид), дезоксипиридинолин, N- и С-телопептиды, кислая тартратустойчивая фосфатаза. Маркеры формирования кости: костный изофермент щелочной фосфотазы, остеокальцин.
Препараты профилактики и лечения остеопороза
Препараты профилактики и лечения остеопороза различны по своему происхождению и химической структуре, но в зависимости от их главного действия можно разделить на два основных класса: препараты антирезорбтивные и стимулирующие костеобразование.
Антирезорбтивные:
- эстрогены;
- СЭРМ (селективные модуляторы эстрогеновых рецепторов);
- бисфосфонаты;
- деносумаб;
- кальцитонин;
- стронция ранелат.
Стимулирующие костеобразование:
- паратгормон;
- анаболические гормоны (андрогены);
- антитело к склеростину;
- стронция ранелат;
- витамин D.
Установлено, что в постменопаузе на фоне дефицита половых гормонов костный обмен возрастает на 20–30 %. Заместительная гормонотерапия (ЗГТ) является первой линией реальной профилактики постменопаузального остеопороза. ЗГТ помогает восстановить костный обмен до уровня пременопаузального, обеспечивая качество кости и адекватное восстановление микроповреждений. Это доказано с помощью гистоморфометрических данных. Даже длительное применение ЗГТ не оказывает отрицательного влияния на костную микроархитектуру [14, 15].
Список зарегистрированных комбинированных препаратов для пероральной ЗГТ:
В фазе менопаузального перехода и перименопаузе:
- Климонорм – левоноргестрел + эстрадиол;
- Климен – ципротерон + эстрадиол;
- Фемостон – дидрогестерон + эстрадиол 2/10 и 1/10.
В постменопаузе:
- Анжелик – дроспиренон + эстрадиол;
- Фемостон – дидрогестерон + эстрадиол 1/5.
К парентеральным эстрогенам относятся трансдермальные лекарственные формы эстрадиола в виде гелей, пластыря (Дивигель, Климара,Эстрожель).
 Применение эстрогенов или СЭРМ является одним из видов профилактики и лечения остеопороза. В настоящее время мы переживаем новую эру в профилактике постменопаузального остеопороза, т. к. показано, что для его профилактики достаточны низкие и ультранизкие дозы эстрадиола [16]. Кроме того, для исключения пролиферативного влияния эстрогенов на матку и молочные железы изучается влияние СЭРМа базедоксифена в комбинации с эстрогенами [17].
Применение эстрогенов или СЭРМ является одним из видов профилактики и лечения остеопороза. В настоящее время мы переживаем новую эру в профилактике постменопаузального остеопороза, т. к. показано, что для его профилактики достаточны низкие и ультранизкие дозы эстрадиола [16]. Кроме того, для исключения пролиферативного влияния эстрогенов на матку и молочные железы изучается влияние СЭРМа базедоксифена в комбинации с эстрогенами [17].
Литературные данные по использованию ЗГТ в ранней постменопаузе с целью профилактики быстрых потерь МПК представлены достаточно широко. Применение ЗГТ не только предотвращает потери костной массы, но и увеличивает МПК у 95 % женщин в постменопаузе. Во всех работах отмечен прирост костной массы в поясничном отделе позвоночника от 2 до 6 % за 12 месяцев. Отмечен более слабый эффект ЗГТ на область бедра.
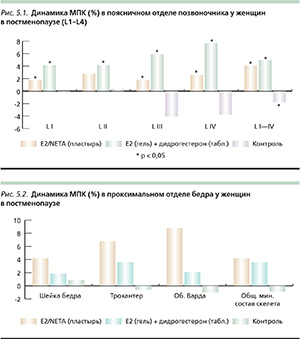
Согласно нашим собственным данным, также установлен положительный эффект различных типов пероральных и трансдермальных эстрогенов и NЕТА (norethisterone acetate) [18, 13]. Для уточнения эффективности трансдермальных форм эстрогенов и прогестагенов у женщин в постменопаузе при снижении МПК мы применили два режима ЗГТ: I – трансдермальный пластырь (Е2 50 мкг/сут) (n = 19); II – 17β-эстрадиол в виде геля 1 мг/сут + дидрогестерон 5 мг/сут (n = 18). Контрольную группу составили 18 женщин, сопоставимых по возрасту, массе тела, МПК и длительности постменопаузы. Средний возраст женщин составил 56,0 ± 5,4 года (46–67 лет). Лечение проводилось 12 месяцев. МПК оценивали методом ДЭРА. Исходно, через 3–9 месяцев определяли уровни маркеров костной резорбции (Пид, Дпид – дезоксиПид) в моче методом хроматографии высокого разрешения в перерасчете на единицу креатинина. Анализ полученных результатов позволил заключить, что ЗГТ вне зависимости от пути введения препаратов оказывает выраженное антирезорбтивное воздействие на костную ткань. ЗГТ (пероральная, трансдермальная или сочетание) способствовала значительному приросту МПК. В области L1–L4 отмечено увеличение МПК на 4,32 и 5,23 % соответственно в I и II группах, в шейке бедра— на 4,90 и 2,08 % соответственно (р < 0,05) (рис. 5.1, 5.2) [13].
Хорошо известно, что ЗГТ эффективна в профилактике остеопороза, если она назначена непосредственно в перименопаузе при наличии факторов риска либо при снижении МПК. Имеются данные, указывающие на выраженное положительное влияние ЗГТ на МПК у женщин старшего постменопаузального возрастов. По данным М. Gambacciani (2003), у женщин в поздней постменопаузе МПК в поясничном отделе за 12 месяцев увеличилась на 3–5 % [16].
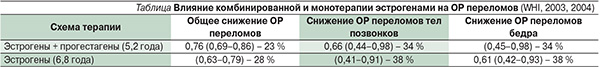
Наиболее мощным рандомизированным слепым плацебо-контролируемым исследованием, изучившим влияние ЗГТ на риск развития рака молочной железы, сердечно-сосудистых заболеваний, переломов и пр., является WHI (Women's Health Initiative – Инициатива во имя здоровья женщин) – исследование, проведенное в 40 клинических центрах США в 1993–2002 гг. Были включены 16 608 постменопаузальных женщин в возрасте от 50 до 79 лет с интактной маткой. Основная группа (n = 8506) принимала комбинированную непрерывную ЗГТ: 0,625 мг конъюгированных эстроге-нов + 2,5 мг МПА (медроксипрогестерона ацетат), II группа – плацебо (n = 8102). Эта группа закончила исследование в 2002 г.
вместо планируемых 8 лет; III группа — женщины без матки (n = 10 739) – принимали только эстрогены [19].
В исследовании WHI достоверно доказано положительное влияние комбинированной ЗГТ на костную ткань женщины: относительный риск (ОР) общих переломов снизился на 23 %, переломов тел позвонков и бедра – на 34 %. Применение монотерапии эстрогенами (конъюгированные эквинэстрогены – 0,625 мг) в течение 6,8 года также показало снижение ОР общих переломов на 28 %, переломов тел позвонков и бедра – на 38 % (см. таблицу) [19].
Таким образом, ЗГТ позитивно влияет на МПК и качество органического матрикса кости у женщин в постменопаузе. ЗГТ высокоэффективна в профилактике постменопаузального остеопороза и для коррекции остеопении.
С целью лечения тяжелого остеопороза рекомендуется использование эстрогенсодержащих препаратов в сочетании с лекарственными средствами других групп (бисфосфонатов, стронция ранелата, деносумаба и др.).
Заключение
ЗГТ достоверно подавляет резорбтивную активность костной ткани. Применение ЗГТ предотвращает потери костной массы, сохраняя МПК, как у здоровых женщин, так и у пациенток с остеопенией, повышая плотность костной ткани. Эффект ЗГТ коррелирует с длительностью терапии и дозами эстрогенов у женщин в ранней постменопаузе. В поздней постменопаузе достаточно эффективны низкие и ультранизкие дозы эстрогенов и прогестагенов. Эффективность ЗГТ повышается при присоединении препаратов кальция (от 800 до 1200 мг), витамина D (от 400 до 800 ME и более) и физической нагрузки. Длительное применение ЗГТ снижает риск переломов различной локализации. Форма применения эстрогенов и тип прогестагена принципиального значения для костного обмена не имеют.


