Препарат двухфазного инсулина аспарт 30/70 (инсулин НовоМикс 30, Novo Nordisk, Дания) относится к двухфазным инсулиновым препаратам, содержащим фиксированные пропорции инсулина короткого (ультракороткого) и пролонгированного действий. Их также называют предварительно смешанными препаратами, или готовыми инсулиновыми смесями. Препарат НовоМикс 30 (двухфазный инсулин аспарт, ДИАсп) применяется в мировой клинической практике уже более 10 лет, в т.ч. и в России [1, 2]. Данная двухфазная смесь состоит из двух компонентов: биосинтетического аналога человеческого инсулина аспарт (30 %), обладающего ультракоротким действием, и кристаллов протаминированных комплексов того же инсулина аспарт, оказывающего гипогликемизирующее действие средней продолжительности (70 %). Первая из составляющих действует преимущественно в постпрандиальном (после приема пищи) периоде, вторая контролирует базальный уровень гликемии. Смесь аспарта и его протаминированной формы устойчива, в то время как инсулин аспарт и человеческий инсулин НПХ (нейтральный протамин Хагедорна) при длительном контакте разлагаются. Кроме того, в смеси с протаминированным аспартом полностью сохраняется ультракороткое действие аспарта [3]. Сейчас можно смело сказать, что НовоМикс 30 – один из наиболее изученных препаратов инсулина, продемонстрировавший высокую эффективность и безопасность как в многочисленных рандомизированных клинических исследованиях, так и в крупных наблюдательных программах.
Двухфазные препараты инсулина создавались прежде всего для лечения сахарного диабета 2 типа (СД2), хотя имеется опыт применения НовоМикс 30 и при СД1 [4].
Именно СД2 составляет стремительно растущую когорту пациентов, заставившую мировое сообщество говорить об «эпидемии неинфекционного заболевания», что отражено в Резолюции ООН, принятой на 61-й Генеральной ассамблее этой организации в 2006 г.
Эффективное лечение СД заключается прежде всего в поддержании целевых уровней гликемии на протяжении многих лет, точнее – на протяжении всей жизни пациента. Для большинства больных СД2 это серьезный вызов, если учесть сопутствующую патологию: артериальную гипертензию, дислипидемию, проявления атеросклероза и т.д., – также требующую контроля и лечения и нередко приводящую к феномену полифармации. Серьезным фактором, усложняющим управление заболеванием, является также возраст большинства пациентов с СД2, затрудняющий выполнение мероприятий по лечению и контролю в силу снижения зрения, двигательных, а порой и когнитивных нарушений. Не секрет, что такие пациенты представляют большую проблему в практике врача-эндокринолога, терапевта, других специалистов, вследствие чего СД часто остается недостаточно компенсированным.
Разумеется, наиболее близок к физиологической секреции инсулина базис-болюсный режим, представляющий собой раздельное введение инсулина короткого и пролонгированного действий, который позволяет варьировать дозу каждой инъекции с учетом всех факторов влияния (актуальные показатели гликемии, содержание углеводов в пище и т.д.). Однако в связи с большим числом инъекций и сложностью комплекса мероприятий по управлению терапевтическим процессом применение базис-болюсного режима не представляется возможным для всех больных СД2, нуждающихся в инсулинотерапии. В связи с этим применение двухфазных препаратов инсулина приобрело широкое распространение и стало высокоэффективной альтернативой базис-болюсному режиму для больных СД2. Соединение двух препаратов с разной продолжительностью действия в одном обеспечивает удобство применения, позволяет избегать ошибок при введении, о которых нередко сообщают пациенты: введение препарата короткого действия вместо продленного, и наоборот. Требуется также меньшее число инъекций в течение дня – 1–3 вместо 4 и более при базис-болюсном режиме.
Однако двухфазные человеческие инсулины (ДЧИ) имеют ряд фармакокинетических и фармакодинамических ограничений, которые могут приводить как к гипергликемии в раннем постпрандиальном периоде, так и к поздней постпрандиальной гипогликемии. Они также требуют примерно 30-минутной паузы между инъекцией и началом приема пищи, которая не всегда выдерживается пациентами. Предварительно смешанные инсулиновые аналоги создавались с целью преодоления перечисленных ограничений в действии ДЧИ. В ряде исследований продемонстрированы лучшие постпрандиальные показатели гликемии при терапии двухфазным аналоговым препаратом инсулина НовоМикс 30 по сравнению с ДЧИ [5], меньший риск гипогликемий, особенно ночных [6, 7] и тяжелых [8, 9]. Эти преимущества обусловлены фармакокинетикой и фармакодинамикой НовоМикс 30, близких к таковым при эндогенной инсулиновой секреции у здоровых людей. В исследовании T. Heise и соавт. продемонстрированы фармакологические преимущества НовоМикс 30 перед ДЧИ с тем же соотношением фракций короткого и продленного действий, выявленных в ходе процедуры 24-часового эугликемического клэмпа [10]. В числе этих преимуществ более высокая концентрация инсулина в крови (73,1–100,4 ЕД/л на НовоМикс 30 против 46,7 –на ДЧИ) 1; более короткое время достижения максимальной концентрации (2,1–2,6 часа на НовоМикс 30 против 3,2 на ДЧИ). Фармакокинетические профили инсулина НовоМикс 30 и ДЧИ представлены на рис. 1.
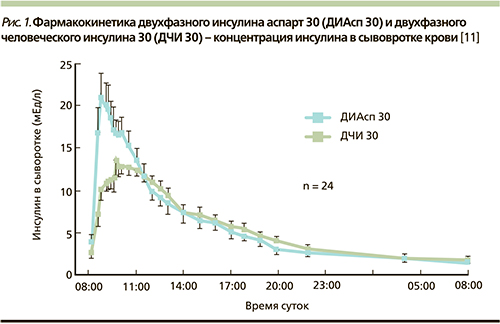
Стоит также отметить сопоставимую эффективность терапии инсулином НовоМикс 30 при введении препарата 3 раза в сутки в сравнении с базис-болюсной терапией [4,12].
Поскольку двухфазные аналоговые смеси инсулина представлены и препаратами с другим соотношением короткой и продленной фракций (25/75 и 50/50), их сравнение особенно интересно. При сравнении НовоМикс 30 и двухфазного инсулина лизпро микс 25 в рамках международного открытого перекрестного исследования 137 пациентов с СД2 [13] оба инсулина привели к сопоставимому снижению уровней гликированного гемоглобина (HbA1c) и гликемии. Частота эпизодов гипогликемий (0,69 и 0,62 эпизода в месяц для НовоМикс 30 и лизпро микс 25 соответственно; p = 0,29) также оказалась близкой.
В исследовании Hermansen и соавт. [14] сравнивали постпрандиальные показатели глюкозы крови на фоне применения инсулина НовоМикс 30, лизпро микс 25 и ДЧИ. НовоМикс 30 продемонстрировал наилучшие показатели постпрандиального контроля, представленные как экскурсия уровня глюкозы в интервале 0–5 часов после еды. Этот показатель на инсулине НовоМикс 30 был на 17 % ниже по сравнению с ДЧИ (p < 0,001) и на 10 % ниже – по сравнению с лизпро микс 25 (p < 0,05). При этом экскурсия уровня глюкозы была ниже как в раннюю (0–2 часа), так и в позднюю (2–5 часов) постпрандиальные фазы при сравнении с ДЧИ (в обоих случаях p < 0,01), и в позднюю – при сравнении с лизпро микс 25 (p < 0,05).
В 16-недельном открытом рандомизированном многоцентровом исследовании Farcasiu и соавт. [15] сравнивали две стратегии интенсификации инсулинотерапии пациентов с СД2, не достигших компенсации на фоне применения двухфазных аналогов инсулина: НовоМикс 30 или лизпро микс 25 (общее число больных – 302). Одна заключалась в переводе на двухфазный препарат инсулина с большим содержанием короткой фракции – лизпро микс 50 – в режиме три инъекции в сутки; другая – в дальнейшей титрации доз исходно получаемых препаратов: НовоМикс 30 или лизпро микс 25 (оба два раза в день). Достоверное и клинически значимое улучшение гликемического контроля наблюдалось в обеих группах, однако итоговый уровень HbA1c не различался между группами (7,70 % в группе лизпро микс 50 3 раза в день и 7,84 % в группе НовоМикс 30 и лизпро микс 25 – 2 раза в день) 2. Отсутствие таких различий авторы связывают с тем, что на терапии лизпро микс 50 3 раза в день отмечен лучший уровень послеобеденной гликемии, но худший – глюкозы плазмы натощак (ГПН) и после завтрака, вероятно, из-за недостаточной дозы продленной фракции инсулина. Очевидно, в связи с этим 27 % больных в группе лизпро микс 50 3 раза в день перешли на прежний режим инсулинотерапии препаратами с меньшим содержанием короткой и большим – продленной инсулиновой фракции перед вечерним приемом пищи.
Таким образом, препараты готовых смесей аналогов инсулина с различным соотношением ультракороткой и пролонгированной фракций позволяют осуществлять индивидуальный подход к лечению СД у пациентов с различной потребностью в инсулине в разное время суток и различным образом жизни, а вовсе не заменяют друг друга.
Как показали исследования, НовоМикс 30 удобен как для инициации, так и для интенсификации инсулинотерапии (используется один препарат в одной шприц-ручке, лишь подбирается соответствующая доза или число инъекций от одной до двух или трех), а кроме того, больные достаточно легко выполняют алгоритм титрации, рекомендованный врачом. Например, в исследование Garber и соавт. (исследование «1–2–3») [16] были включены 100 больных СД2 с уровнем HbA1c в диапазоне 7,5–10,0 %: из них 72 ранее получали пероральные сахароснижающие препараты (ПССП), остальные – ПССП в комбинации с базальным инсулином. Пациентам назначали НовоМикс 30, отменив при этом базальный инсулин, если пациент его получал. Лечение начинали с одной инъекции в день с последующей самостоятельной титрацией дозы инсулина НовоМикс 30 до достижения целевого уровня ГПН 4,4–6,1 ммоль/л. Через 16 недель терапии 21 % пациентов достигли целевого уровня HbA1c ≤ 6,5 %, а HbA1c ≤ 7,0 % – 41 % пациентов. Оставшимся больным была назначена вторая инъекция НовоМикс 30 в сутки. Еще через 16 недель целевого уровня HbA1c ≤ 6,5 % достигли 52 % больных, HbA1c ≤ 7,0 % – 70 % пациентов. Оставшимся назначили третью инъекцию ДИАсп 30 еще на 16 недель.
Использование такого поэтапного алгоритма титрации НовоМикс 30 (постепенный переход от одной к трем инъекциям при недостижении терапевтических целей) позволило большинству пациентов достичь в конце исследования целевого контроля гликемии: уровня HbA1c ≤ 6,5% достигли 60% больных, ≤ 7,0 % – 77 % пациентов. Следует отметить, что увеличение кратности введения ДИАсп 30 на протяжении всего исследования не сопровождалось увеличением риска тяжелых гипогликемий (требующих посторонней помощи для купирования).
Более того, на протяжении всего исследования не было зарегистрировано ни одного случая тяжелой гипогликемии.
А частота легких (купирующихся пациентом самостоятельно) гипогликемий не коррелировала с числом инъекций в течение дня.
Еще более впечатляющие результаты были получены Lightelm и соавт. [17] в открытом нерандомизированном проспективном обсервационном исследовании длительностью 18 месяцев, проведенном в условиях повседневной клинической практики. НовоМикс 30 назначали больным СД2, у которых лечение ПССП (n = 90) или предшествующий режим инсулинотерапии (n = 59) оказались неэффективными (исходный средний уровень HbA1c составлял 8,4 %). В течение 10 недель от начала терапии больных обучали методам самоконтроля гликемии и коррекции дозы НовоМикс 30 с использованием простого алгоритма титрации: вначале применяли алгоритм подбора дозы по результатам измерения ГПН, а после того как пациенты им овладевали, их обучали второму алгоритму подбора дозы по результатам самоконтроля после еды. Необходимость увеличения числа инъекций определял врач. К окончанию исследования у всех участников отмечено статистически значимое снижение уровня HbA1c в среднем на 1,9 ± 0,1 %.
Уровень HbA1c < 7,0% был достигнут у 90 % больных, ≤ 6,5 % – у 52 %.
Тяжелых и ночных гипогликемий не зафиксировано, легкие отмечены у 15 % больных. Масса тела пациентов, ранее не получавших инсулина, возросла в среднем на 2,7 кг, а у больных, переведенных на НовоМикс 30 с других препаратов инсулина, снизилась в среднем на 0,6 кг.
Таким образом, удобство применения препарата НовоМикс 30, успешное освоение пациентами алгоритма титрации в условиях обычной клинической практики позволяют достигать целевых показателей углеводного обмена подавляющему большинству больных (90 %) при очень хорошем профиле безопасности: незначительное количество только легких гипогликемий и даже некоторое снижение массы тела при переводе с других препаратов инсулина.
Хотя рандомизированные контролируемые исследования считаются «золотым» стандартом с точки зрения доказательной медицины, проспективные наблюдательные программы представляют огромный интерес как этап внедрения результатов этих испытаний в клиническую практику. Наблюдательные программы позволяют охватить большое количество пациентов, по своим демографическим и медицинским характеристикам в большей степени соответствующих реалиям общей клинической практики, выявлять редкие побочные эффекты, не проявляющиеся в малых выборках.
Особый интерес для отечественного эндокринологического сообщества представляет тот факт, что в ряде наблюдательных исследований (PRESENT, IMPROVE, A1chieve) с применением инсулина НовоМикс 30 приняли участие и российские пациенты 3. Результаты этих масштабных программ опубликованы как в международных [18–31], так и в отечественных научно-медицинских журналах [32, 33].
Ниже представлены результаты недавно завершенной крупнейшей международной наблюдательной программы A1chieve, целью которой было всестороннее изучение эффективности и безопасности терапии СД2 аналоговыми препаратами инсулина – НовоМикс 30, детемир (Левемир) и аспарт (НовоРапид), в реальной клинической практике. Всего в исследовании приняли участие 66 726 пациентов с СД2 из 28 стран мира, расположенных на 4 континентах (более 3000 пациентов из России). Всего 40 917 пациентов с СД2, участвовавших в программе A1chieve, использовали НовоМикс 30 в качестве монотерапии или в комбинации с ПССП (из них 27,6 тыс. «инсулин-наивных» и 13,3 тыс. ранее получавших другие препараты инсулина); Российская когорта составила 1226 пациентов (730 пациентов, не получавших ранее инсулин, и 496 – имевших предшествующий опыт лечения инсулином). Данные представлены на информационном портале The A1chieve Resource Centre http://www.a1chieve.com
Применение НовоМикс 30 привело пациентов, как ранее не получавших инсулин, так и переведенных с других инсулинов, к улучшению гликемического контроля через 24 недели (снижение HbA1c на 2,5 и 2,0 %, глюкозы плазмы натощак – ГПН – на 4,5 и 3,1 ммоль/л, постпрандиальной гликемии – ППГ – на 5,2 и 3,5 ммоль/л у ранее не получавших и получавших инсулин пациентов соответственно). Около 30 % пациентов к концу исследования достигли HbA1c < 7 %. Средняя дневная доза НовоМикс 30 через 24 недели составила 44,0 и 51,8 ЕД для ранее не получавших и получавших инсулин пациентов. У лиц, имевших предшествующий опыт лечения инсулином, частота всех и ночных гипогликемий после перевода на ДИАсп снизилась на 7,0 и 2,6 случая/пациента/год сответственно. Вполне закономерно, что начало применения инсулина у ранее не получавших инсулин пациентов сопровождалось увеличением легких гипогликемий, однако их частота увеличилась незначительно (на 3,2 случая/пациента/год). Кроме того, несмотря на наличие избыточной массы тела у большинства участников (средний индекс массы тела – ИМТ – в анализируемой когорте в начале исследования составил 31,2 кг/м2); терапия НовоМикс 30 не привела к дополнительному увеличению массы тела: через 24 недели масса тела снизилась на 0,2 и 1,0 кг у ранее не получавших и получавших инсулин.
Дополнительным, не менее значимым преимуществом терапии инсулином НовоМикс 30 кроме значительного и безопасного улучшения гликемического контроля было клинически значимое улучшение ассоциированного со здоровьем качества жизни пациентов (по оценке с использованием стандартного опросника EQ-5D – EuroQol-5D) [26].
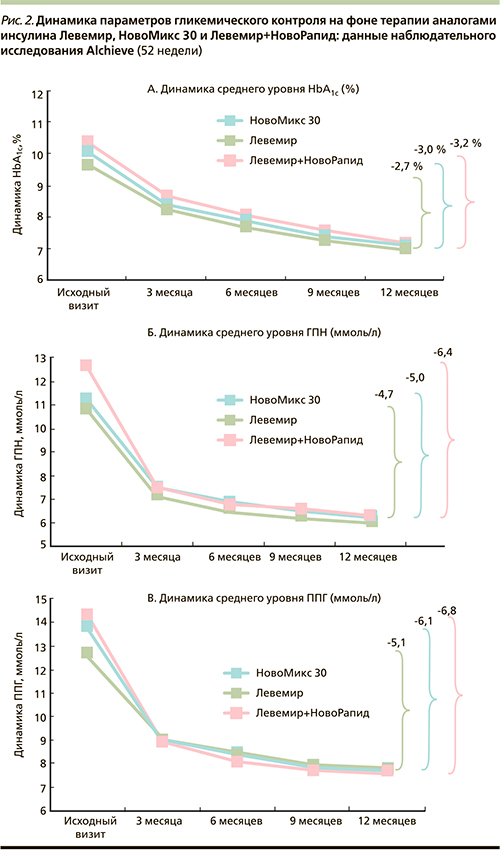
Отдельное исследование, выполненное в рамках международной проспективной наблюдательной программы A1chieve в России (n = 9 342, длительность – 52 недели), также продемонстрировало высокую эффективность и безопасность в отношении риска гипогликемий терапии НовоМикс 30. Начало инсулинотерапии пациентов с СД2 без предшествующего опыта лечения инсулином аналогами инсулина Левемир (инсулин детемир), НовоМикс 30 или базис-болюсным режимом Левемир + НовоРапид в условиях повседневной клинической практики способствовало выраженному улучшению гликемического контроля (через 12 месяцев снижение HbA1c на 2,9 %) при отсутствии негативного влияния на переносимость и безопасность терапии [34].
Примечательно, что при выборе режима для старта инсулинотерапии около трети (29 %) врачей отдали предпочтение НовоМикс 30. Более того, если число пациентов, начавших терапию с базального аналога инсулина, к концу исследования уменьшилось за счет необходимости интенсификации терапии путем добавления болюсного инсулина, то число больных, получавших терапию ДИАсп, через 12 месяцев даже несколько увеличилось (до 32 %).
Характерно также, что наиболее оптимальный гликемический контроль с точки зрения улучшения всех параметров гликемии (особенно ППГ как независимого неблагоприятного фактора сердечно-сосудистого риска) наблюдался именно в подгруппе пациентов, получавших НовоМикс 30. Динамика HbA1c и ППГ была сопоставимой с таковой при лечении базис-болюсным режимом (снижение уровня HbA1c при лечении базальным инсулином на 2,7 %, при лечении ДИАсп – на 3,0 % и на базис-болюсной терапии – на 3,3 %; снижение ППГ на 5,1, 6,1 и 6,8 ммоль/л соответственно) (рис. 2).
Динамика ГПН на фоне терапии инсулином НовоМикс 30 была сопоставимой с таковой при использовании базального инсулина (снижение на 5,0 и 4,7 ммоль/л по сравнению с исходным уровнем соответственно).
Тяжелые гипогликемии на фоне лечения инсулином НовоМикс 30, как и другими исследуемыми режимами инсулинотерапии, отмечались крайне редко [34]. Прибавка массы тела на фоне терапии ДИАсп в течение года практически отсутствовала (+0,1 кг через 6 месяцев без дальнейшего роста массы тела в течение последующий 6 месяцев).
Важным компонентом представленного исследования A1chieve было изучение удовлетворенности лечением пациентов, которое проводили исходно и через 12 месяцев с использованием валидированной русскоязычной версии специфического опросника DiabMedSat© (Diabetes Medication Satisfaction Questionnaire). На фоне всех исследуемых режимов инсулинотерапии с использованием аналогов инсулина отмечена выраженная положительная динамика этого показателя (увеличение оценки с 33,3 балла во время исходного визита до 76,2 – в конце исследования, т.е. +42,8 балла за 12 месяцев) [34]. При этом повышение удовлетворенности лечением через 6 месяцев после инициации инсулинотерапии было наиболее выраженным при старте с НовоМикс® 30, что, скорее всего, отражает субъективную высокую оценку эффективности и безопасности терапии этим инсулином, а также удобство и простоту его применения.
Таким образом, данное наблюдательное исследование, проведенное в России, также подтвердило все преимущества лечения двухфазным аналогом инсулина НовоМикс 30: высокую эффективность в отношении улучшения всех параметров гликемического контроля, безопасность в отношении гипогликемий и влияния на массу тела, а также благоприятное отношение к нему пациентов.
Наконец, поскольку основной контингент пациентов, получающих НовоМикс 30, – люди старшего возраста, большой интерес представляют опубликованные недавно данные субанализа эффективности и безопасности применения инсулина НовоМикс 30 в разных возрастных группах в рамках 26-недельного международного исследования A1chieve [29].
Из 40 917 пациентов, получавших НовоМикс 30, 4347 были моложе 40 лет, 29 036 – в возрасте 40–65 лет и 6739 – старше 65 лет. Большая часть (65 %) из них не имела предшествующего опыта инсулинотерапии.
Следует отметить, что при исходно схожем во всех возрастных группах неудовлетворительном контроле (средний уровень HbA1c – 9,4–9,6 %) через 24 недели динамика HbA1c также была очень близкой: снижение HbA1c на 2,3 % у пациентов моложе 40 лет и на 2,0 % в других возрастных группах (p < 0,001 во всех группах). При этом динамика уровня HbA1c была более выраженной у пациентов без предшествующего опыта лечения инсулином.
Снижение ГПН и ППГ было выраженным во всех возрастных группах, максимально выраженная положительная динамика наблюдалась у пациентов моложе 40 лет (снижение ГПН на 4,2 ммоль/л; ППГ – на 6,1 ммоль/л), минимальная – у пациентов старше 65 лет (ГПН – -3,4 ммоль/л; ППГ – -4,0 ммоль/л), во всех случаях разница была достоверной (p < 0,001) [29].
Доля пациентов, перенесших хотя бы одну гипогликемию (любые эпизоды), достоверно снизилась во всех возрастных группах, хотя и отмечено незначительное увеличение этого показателя у лиц без опыта лечения инсулином старше 65 лет (c 3,8 ± 0,99 случая/пациента/год исходно до 6,1 ± 1,49 случая/пациента/год; p < 0,001) [29]. В то же время во всей анализируемой выборке доля больных с тяжелыми гипогликемиями достоверно снизилась – до 0–0,1 %. Даже у больных без предшествующего опыта инсулинотерапии в возрасте 40–65 и старше 65 лет на протяжении всего периода наблюдения (24 недели) тяжелых гипогликемий не было зарегистрировано (исходно частота тяжелых гипогликемий у пациентов, не применявших ранее инсулин, в возрасте моложе 40 лет, 40–65 и старше 65 лет составила 0,2 ± 0,03, 0,5 ± 0,08 и 0,8 ± 0,15 случая/пациента/год; p < 0,001 соответственно). Доля пациентов, перенесших ночные гипогликемии, также достоверно уменьшилась во всех возрастных группах, кроме лиц старшего возраста (≥ 65 лет), не имевших предшествовавшего опыта инсулинотерапии, хотя и среди них эта доля была невелика (1,6 ± 0,33 через 24 недели против 1,3 ± 0,32 случая/пациента/год исходно).
Независимо от возраста и предшествующей терапии прибавка массы тела была незначительной: 0,2–0,7 кг.
Результаты представленного субанализа подтверждают, что независимо от возраста как при инициации инсулинотерапии, так и при переводе с других препаратов инсулина НовоМикс 30 обеспечивает существенное улучшение гликемического контроля. Увеличение доли пациентов с легкими гипогликемиями среди пациентов старше 65 лет без предшествующего опыта инсулинотерапии еще раз подчеркивает необходимость обучения таких пациентов как в начале лечения инсулином, так и в дальнейшем.
Подводя итоги, можно констатировать, что десятилетний опыт применения двухфазного аналога инсулина НовоМикс 30 надежно подтвердил его высокую эффективность, безопасность, удобство и простоту инициации и интенсификации инсулинотерапии ДИАсп. Также НовоМикс 30 может использоваться в качестве альтернативы базис-болюсному режиму при интенсификации терапии после базального инсулина, когда возможность соблюдения режима многократных инъекций двух различных видов инсулина, а также проведение регулярного самоконтроля гликемии, необходимого для успеха базис-болюсной терапии, затруднены или невозможны.
Конфликт интересов
Автор заявляет об отсутствии конфликта (двойственности) интересов в связи с подготовкой данной рукописи.


