Введение
Распространенность сахарного диабета 1 типа (СД1) в Российской Федерации составляет 259,3 на 100 тыс. населения (около 340 тыс.), большинство из которых – люди работоспособного возраста [1]. Разработка и использование практически беспиковых аналогов инсулина длительного действия гларгина (IGlar) и детемира привели к снижению частоты гипогликемий, негативно влияющих на здоровье и самочувствие пациента, снижающих качество жизни, препятствующих своевременной оптимизации и интенсификации инсулинотерапии. Однако, согласно опубликованным данным, частота гипогликемических реакций при СД1 остается достаточно высокой (30–40% в год) [2]. Пациенты с длительным анамнезом заболевания более подвержены риску развития гипогликемических реакций: около 50% таких больных, находящихся в хорошей компенсации, имеют минимум 1 эпизод тяжелой гипогликемии за 9–12 месяцев. Еще одной серьезной проблемой является возникновение бессимптомных (неосязаемых) гипогликемий, когда пациенты теряют способность чувствовать симптомы гипогликемии из-за нарушенной секреции глюкагона и адреналина, что может приводить к развитию гипогликемической комы. Все эти факторы оказывают негативное влияние на качество жизни пациента по сравнению с популяционной нормой. Страх возникновения гипогликемии способствует формированию у больных повышенного уровня тревоги и депрессии, а также негативно влияет на качество жизни.
Достижение адекватного гликемического контроля – одна из наиболее актуальных задач современной фармакотерапии СД1. Важнейшим клиническим показателем оценки эффективности сахароснижающей терапии и индикатором долгосрочного риска развития хронических осложнений СД является гликированный гемоглобин (HbA1c). В то же время данный маркер не всегда коррелирует со степенью достижения оптимального качества жизни пациента при данном заболевании. К новому поколению базальных инсулинов ультрадлительного действия относится инсулин деглудек (IDeg). Препарат доступен для лечения пациентов во многих странах мира под торговым названием Тресиба®, в России он был одобрен с октября 2014 г.
Эффективность и безопасность IDeg в комбинации с инсулином аспарт были подробно изучены в программе клинических исследований BEGIN, в т.ч. среди больных СД1 [4]. В течение 24 месяцев лечения на большой группе пациентов было показано, что при сходной клинической эффективности с IGlar по влиянию на динамику уровня HbA1c в группе пациентов, находившихся на лечении IDeg, было отмечено достоверное снижение числа ночных гипогликемий на 25%, а также снижение числа общих гипогликемий на 7%. Полученные преимущества более безопасного использования инновационного инсулина объясняются уникальным стабильным (плоским) фармакокинетическим и фармакодинамическим профилем его действия при однократном введении в сутки и значительным снижением вариабельности уровня гликемии в этот период.
В данной статье описаны результаты 12-недельного сравнительного наблюдательного проспективного исследования IDeg и IGlar на больных с СД1 в российской популяции в условиях рутинной практики лечения.
 Целью настоящего исследования стало изучение терапевтического потенциала использования IDeg в составе базис-болюсной инсулинотерапии (в комбинации с ультракоротким аналогом человеческого инсулина) у пациентов с СД1 по сравнению с IGlar на основании динамики показателей гликемического контроля, частоты, степени тяжести гипогликемических состояний и чувствительности к гипогликемии, а также изменений оценки ассоциированного со здоровьем качества жизни и психоэмоционального статуса.
Целью настоящего исследования стало изучение терапевтического потенциала использования IDeg в составе базис-болюсной инсулинотерапии (в комбинации с ультракоротким аналогом человеческого инсулина) у пациентов с СД1 по сравнению с IGlar на основании динамики показателей гликемического контроля, частоты, степени тяжести гипогликемических состояний и чувствительности к гипогликемии, а также изменений оценки ассоциированного со здоровьем качества жизни и психоэмоционального статуса.
Характеристика пациентов и методы исследования
В наблюдательное проспективное исследование были включены 46 больных СД1 в возрасте от 18 лет с нецелевым контролем гликемии, ранее в течение продолжительного времени (>1 года) получавших терапию IGlar в комбинации с ультракоротким аналогом инсулина, проходивших обследование и лечение в клинике эндокринологии УКБ № 2 Первого МГМУ им. И.М. Сеченова с 01.10.2015 по 01.02.2016. Пациентами было подписано информированное согласие на участие в наблюдательном исследовании. Критерии исключения: возраст менее 18 лет, наличие тяжелых осложнений СД1 либо тяжелых сопутствующих соматических, психических или онкологических заболеваний.
Решение о распределении в основную, получавшую IDeg, или контрольную, получавшую IGlar, группу лечащий врач принимал самостоятельно, исходя из предпочтений пациента.
В основную группу вошли 25 больных СД1 (7 мужчин и 18 женщин; средний возраст – 38,04±14,98 года, Ме [20÷63]).
Группу сравнения составил 21 больной СД1 (6 мужчин и 15 женщин; средний возраст – 43,19±16,93 года, Ме [23÷69]),
продолживших терапию IGlar. Препараты базального инсулина применялись подкожно 1 раз в день в соответствии с инструкцией по медицинскому применению. При переводе пациентов с IGlar на IDeg рассчетная начальная суточная доза IDeg была на 25% меньше, чем исходная суточная доза базального инсулина. Инъекция инсулина ультракороткого действия выполнялась перед приемом пищи, коррекция дозы прандиального инсулина проводилась пациентом исходя из показателей гликемии перед приемом пищи. Средний период наблюдения составил 95 дней.
Исходное и заключительное обследования пациентов включили сбор анамнеза, оценку социально-демографических характеристик, физикальное исследование, динамическую оценку гликемического профиля (регулярное ведение пациентом дневника с измерением гликемии натощак и в течение дня не менее 4 раз в день, исследование уровня HbA1c. Данные заносили в индивидуальные регистрационные карты, составленные на основе немецкого популяционного исследования у пациентов с СД1, проведенного в 1998 г. [6]. В картах были предусмотрены разделы для сбора социально-демографических характеристик, личного и семейного анамнеза, анамнеза заболевания, курения, особенностей проводимой инсулинотерапии, гипогликемий, данных физикального и лабораторного обследования, особенностей проведения самоконтроля и др. Физикальное обследование включило измерение роста, веса, определение индекса массы тела (ИМТ). Лабораторно определяли уровень HbA1c методом высокоэффективной жидкостной хроматографии, сертифицированным в соответствии с National Glycohemoglobin Standartization Program и стандартизированным в соответствии с референсными значениями, принятыми в Diabetes Control and Complications Trial.
Все пациенты исходно и через 3 месяца от начала наблюдения самостоятельно заполняли стандартизированные опросники оценки качества жизни, депрессии, диагностики гипогликемии. С каждым больным было проведено индивидуальное занятие для обучения принципам и критериям диагностики и определения степени тяжести гипогликемии, а также лечения (купирования) гипогликемии. Под «легкой гипогликемией» понимали состояние, сопровождавшееся снижением уровня сахара в крови ниже 3,9 ммоль/л и автономными симптомами гипогликемии, включившими тошноту, повышение чувства голода, чувство повышенной нервозности или раздражительности, чувство холода, озноба, повышенную потливость, учащенное сердцебиение, дрожь в руках или в теле. При этом пациент должен быть способным купировать гипогликемию самостоятельно.
В качестве критериев «гипогликемии средней тяжести» были приняты снижение уровня сахара в крови при самоконтроле ниже 3,0 ммоль/л, сопровождающееся как автономными, так и нейрогликопеническими симптомами: изменением настроения, внутренней дрожью, чувством усталости, тревожностью, чувством голода, нарушениями остроты зрения, координации движений, походки, речи, сна или бессонницей, головокружением, головной болью, выраженной слабостью, сонливостью. Пациент должен был быть способным купировать гипогликемию самостоятельно.
Под «тяжелой гипогликемией» понимали состояние, сопровождавшееся значительным снижением уровня сахара (ниже 1,9–2,2 ммоль/л) и возникновением тяжелых нейрогликопенических симптомов, включавших судороги, потерю сознания, развитие коматозного состояния. Данное состояние обязательно требует помощи постороннего человека.
Для выявления «неосязаемых» гипогликемий (нарушение распознавания гипогликемии) применили метод суммарных оценок с использованием 7-балльной шкалы Лайкерта [4, 5]: пациент должен был ответить на вопрос: «знает ли он, когда у него возникает гипогликемия?», где 1 – «всегда знаю», 7 баллов – «никогда не знаю», а оценка 4 и более подразумевает нарушение осознания гипогликемии [6]. Выявление гипогликемических состояний проведено с помощью опросника по диагностике гипогликемии (Hypoglycemia questionnaire), разработанного Австралийской ассоциацией здоровья (Hypoglycemic Health Association of Australia) [7].
 Качество жизни, связанное со здоровьем, исследовано с помощью русской версии неспецифического опросника Euro Quality of Life (EQ-5D), широко используемого в популяционных и клинических исследованиях [9].
Качество жизни, связанное со здоровьем, исследовано с помощью русской версии неспецифического опросника Euro Quality of Life (EQ-5D), широко используемого в популяционных и клинических исследованиях [9].
Опросник состоит из 2 частей. В 1-ю часть входит 5 разделов, характеризующих различные проблемы, связанные со здоровьем (возможность передвижения в пространстве; уход за собой/самообслуживание; выполнение привычной повседневной деятельности, включая работу по дому, учебу, досуг, участие в делах семьи; наличие боли или дискомфорта, психологических проблем в виде тревоги и/или депрессии). В зависимости от степени выраженности проблемы каждый раздел (шкала) оценивается по 3 уровням: 1 – нет нарушений, 2 – умеренные нарушения, 3 – выраженные нарушения. Вторая часть представляет визуально-аналоговую шкалу в виде вертикальной градуированной линейки («термометра здоровья»), на которой «0» означает самое плохое, а «100» – самое хорошее состояние здоровья. Психоэмоциональный статус пациентов оценивался с помощью шкалы депрессии Бека (Beck Depression Inventory, BDI).
Учитывая небольшой размер выборки изучаемых групп пациентов, все полученные параметры оценивались методами непараметрической статистики с помощью пакета прикладных программ Portable PASW Statistics 18 и Microsoft Excel 2010. Количественные показатели были представлены в виде Ме±σ (среднее значение±среднеквадратичное отклонение). Сравнение количественных показателей в изучаемых группах осуществлено при помощи U-критерия Манна–Уитни и Z-критерия Уилкоксона с доверительным интервалом 95%. Для сравнения качественных признаков использован критерий χ2. Различия считали статистически достоверными при уровне значимости р<0,05. Корреляционный анализ проведен с использованием метода ранговой корреляции Спирмена.
Результаты исследования
Оценка эффективности лечения аналогами инсулина деглудек и гларгин
Исходно пациенты обеих групп статистически значимо не различались по основным клинико-лабораторным и социально-демографическим показателям (табл. 1). Большинство пациентов на момент обследования имели нормальный вес (ИМТ=24 кг/м2). Средняя длительность заболевания от момента постановки диагноза составила 13,11±11,0 лет (Ме[1÷46]) в основной группе и 16,13±10,11 лет (Ме[1÷38]) в группе сравнения. Сле-дует отметить, что среди пациентов обеих группы была выявлена высокая частота курильщиков (35 и 14% в группе IDeg и IGlar соответственно). Более половины больных обеих групп имели законченное высшее образование. Большая часть (56% IDeg и 37% IGlar) пациентов работали с полной занятостью, несмотря на то, что более половины наблюдавшихся больных имела 2-ю или 3-ю группу инвалидности.
Исходно на момент включения в исследование средняя суточная доза IGlar в группе больных, переведенных на IDeg, составила 20,08±8,11 ЕД, Ме [12,0÷36,0]; в группе пациентов, продолживших лечение IGlar, средняя суточная доза равнялась 19,52±11,24 ЕД, Ме [10,0÷52]. Через 3 месяца лечения средняя суточная доза IDeg составила 14,07±5,26 ЕД, что было ниже исходной дозы на 26,2%.
Пациенты обеих групп на протяжении всего периода наблюдения проводили регулярный самоконтроль уровня гликемии в среднем 4 раза в день. Следует отметить, что все больные, включенные в исследование, проходили обучение в Школе для лиц с СД1, владели навыками самоконтроля и проведения коррекции дозы инсулина ультракороткого действия, однако целевой уровень HbA1c на момент включения в исследование <7% наблюдался лишь у 3 больных основной и 4 больных группы сравнения. Мотивом принятия решения об участии в исследовании, предполагающего возможный перевод на новый инсулин ультрадлительного действия, стала высокая частота гипогликемических состояний на IGlar. Исходно средний показатель HbA1c в группах IDeg и IGlar достоверно не различался и составил 8,30±1,66% [6,1;13,7] и 8,65±1,62% [6,0;12,7] соответственно.
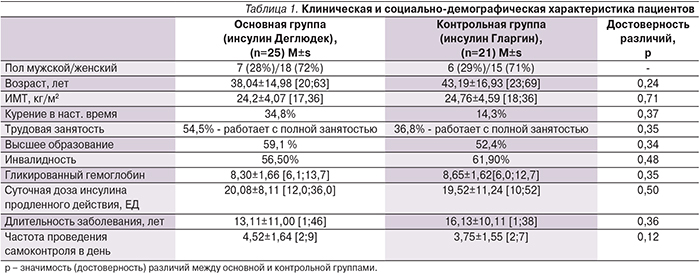
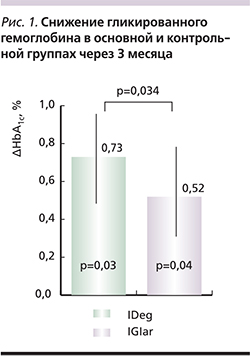
На фоне проведенной терапии как в группе IDeg, так и в группе IGlar было достигнуто статистически значимое снижение HbA1c, однако динамика снижения на IDeg была более выраженной и cоставила 0,73% по сравнению с 0,52% на IGlar (рис. 1). Наибольшая динамика данного показателя была отмечена у пациентов с исходно более высоким уровнем НbА1с (рис. 2). За 3 месяца терапии инсулином IDeg средняя суточная доза базального инсулина снизилась на 26% и составила 14,07±5,26 ЕД.
Оценка безопасности инсулинов деглудек и гларгин
Для анализа безопасности лечения и оценки побочных эффектов инсулинотерапии исследовали частоту, степень тяжести гипогликемических состояний, а также динамику показателя чувствительности к гипогликемии.
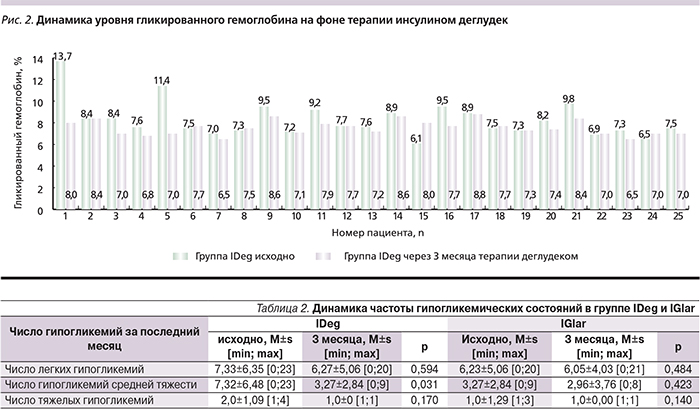
Исходно в группе IDeg количество легких, средней тяжести и тяжелых гипогликемических состояний было несколько больше по сравнению с группой IGlar (табл. 2). Перевод на IDeg способствовал значимому существенному снижению числа гипогликемий средней тяжести на 44,6% (р=0,031) и числа ночных гипогликемий – на 33%. Число легких и тяжелых гипогликемических состояний достоверно не изменилось (см. табл. 2).
В группе IGlar в течение 3 месяцев лечения от момента включения в исследование не наблюдалось уменьшения числа гипогликемических состояний.
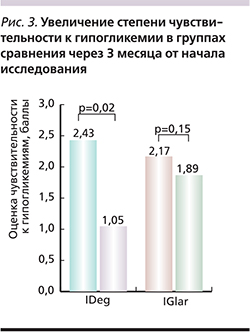
Идентификация и определение частоты «неосязаемых» гипогликемий проведены на основании самостоятельной оценки пациентами своего состояния с использованием 7-балльной шкалы Лайкерта. Самое низкое значение шкалы соответствовало наилучшему ощущению пациентом симптомов гипогликемии. На основании полученных результатов был расcчитан средний балл чувствительности к гипогликемии, который в группе IDeg исходно составил 2,43±2,1 и 2,17±2,7– в группе IGlar. Через 3 месяца проводимой терапии отмечено достоверное улучшение показателя чувствительности к гипогликемии в основной группе – до 1,05±1,74 балла (p=0,02). В группе IGlar отмечено лишь незначительное улучшение исследуемого параметра (рис. 3).
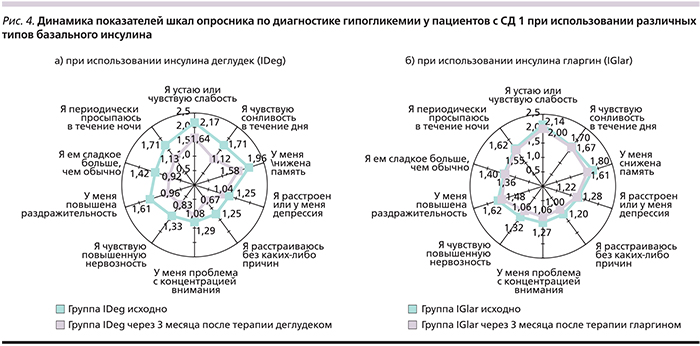
Опросник по диагностике гипогликемии включает 10 вопросов, касающихся физических и психологических симптомов гипогликемии, с градацией ответов: «никогда», «редко», «время от времени», «обычно». При суммарной оценке менее 8 гипогликемия маловероятна, от 8 до 15 – возможна, более 15 – присутствует. Анализ данных опросника Hypoglycemia questionnaire показал, что суммарный балл, отражающий вероятность гипогликемических реакций исходно и через 3 месяца терапии, в группе IDeg снизился с 15,54±5,82 (±SD) до 10,68±6,65 (±SD) и с 14,34±4,98 до 12,47±5,15 (±SD) в группе лечения IGlar. Однако, несмотря на более выраженное уменьшение средней суммарной оценки в основной группе, чем в группе сравнения, через 3 месяца наблюдения в обеих группах она все еще соответствовала градации «возможное гипогликемическое состояние». Характеристика отдельных шкал опросника по диагностике гипогликемии группы IDeg и IGlar до и через 3 месяца терапии представлена на рис. 4. Через 3 месяца после перевода на IDeg по большинству показателей пациентами было достигнуто статистически достоверное улучшение.
Корреляционный анализ в группе IDeg выявил статистически достоверные связи. Так, повышение суточной дозы инсулина ассоциировалось с повышением раздражительности (r=0,536; р=0,032), нервозности (r=0,454, р=0,039), нарушениям сна ночью (r=0,466, р=0,033); а увеличение уровня HbA1c было связано с нарушением сна (r=0,515, р=0,012). Регистрация при самоконтроле уровня гликемии, ниже которого пациент считал, что у него гипогликемия, приводила к повышению слабости (r=0,430, р=0,046) и нервозности (r=0,461, р=0,031). Увеличение числа ночных гипогликемий (r=0,479, р=0,032), а также «легких» гипогликемий (r=0,533, р=0,019) повышало раздражительность.
В группе IGlar увеличение суточной дозы инсулина сопровождалось увеличением потребности в сладком (r=0,695, р=0,008), а увеличение уровня HbA1c было связано с нарушением сна (r=0,512, р=0,036). Кроме того, выявлена положительная достоверная корреляция между количеством гипогликемий и сонливостью в течение дня (r=0,783, р=0,001), количеством легких гипогликемий и нарушением сна ночью (r=0,606, р=0,028). Количество среднетяжелых гипогликемий, при которых присутствуют симптомы гипогликемии, мешающие жизнедеятельности, однако не требующие помощи постороннего человека, было связано с усилением слабости (r=0,787, р=0,001), сонливости в течение дня (r=0,801, р=0,001), снижением памяти (r=0,744, р=0,004), повышенной раздражительностью (r=0,626, р=0,022), увеличением потребности в приеме сладкой пищи (r=0,596, р=0,041), нарушением сна ночью (r=0,634, р=0,015).
Оценка общего состояния здоровья
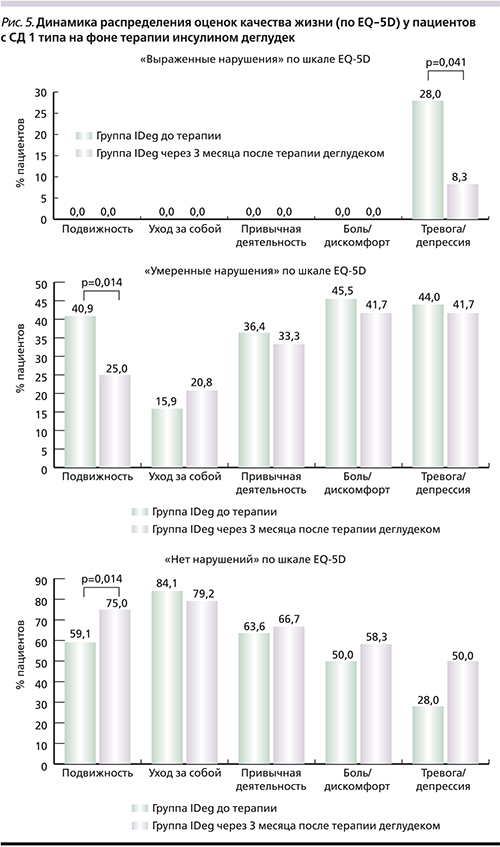
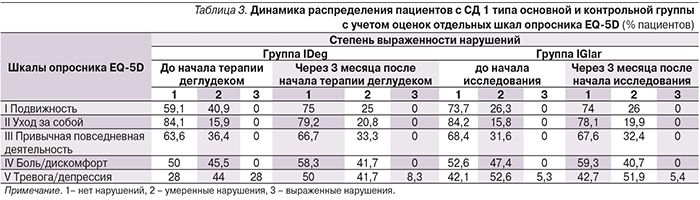
Оценка самим пациентом различных аспектов своего здоровья, а также влияние на него медицинской помощи является важным показателем его общего состояния, независимым прогностическим фактором и инструментом для выбора дальнейшей тактики лечения [8]. Профиль качества жизни (по EQ-5D), описывающий состояние здоровья пациентов по 5 шкалам, представлен в табл. 3. При оценке динамики качества жизни по EQ-5D в группе IDeg по шкале «Подвижность» выявлено статистически достоверное (р=0,014) увеличение числа пациентов, выбравших вариант «нет нарушений» с 59,1 до 75%, уменьшение числа пациентов с 40,9 до 25% с «умеренными нарушениями» (рис. 5). По шкале «Тревога/депрессия» достоверно увеличилось число пациентов, выбравших ответ «нет нарушений» (с 28 до 50%), уменьшилось число пациентов с «умеренными нарушениями» (с 44 до 41,7%), а также уменьшилось число пациентов, оценивших свое состояние как тяжелое (с 28 до 8,3%). В группе исходно отсутствовали пациенты, которые бы оценили свое состояние как «тяжелое» по категориям «Подвижность», «Уход за собой», «Привычная повседневная деятельность», «Боль/дискомфорт».
В группе IGlar через 3 месяца терапии увеличилось число пациентов, исходно оценивших свое состояние как «нет нарушений» (с 52,6 до 59,3%), уменьшилось количество больных с «умеренными нарушениями» (с 47,4 до 40,7%) по категорию «Боль/дискомфорт» (p=0,41); по остальным категориям опросника выраженной динамики не отмечено.
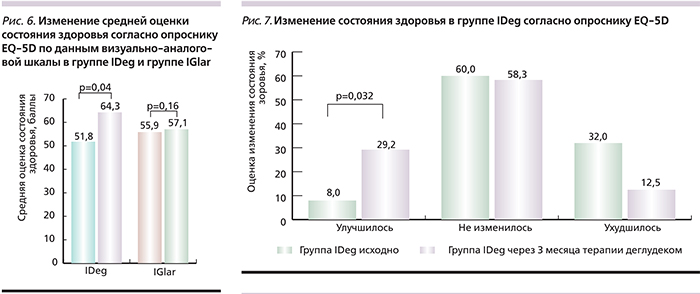
Терапия IDeg ассоциировалась с более выраженным улучшением средней оценки статуса здоровья по визуально-аналоговой шкале EQ-5D (рис. 6): через 3 месяца после начала терапии средняя оценка в группе IDeg увеличилась с 51,8 исходно до 64,3 балла (p=0,04), в группе IGlar данный показатель изменился незначительно – с 55,9 до 57,1 балла (p=0,16). Доля пациентов, отметивших улучшение состояния здоровья через 3 месяца лечения IDeg, увеличилась с 8 до 29,2% (р=0,032) (рис. 7).
Изменение психоэмоционального статуса
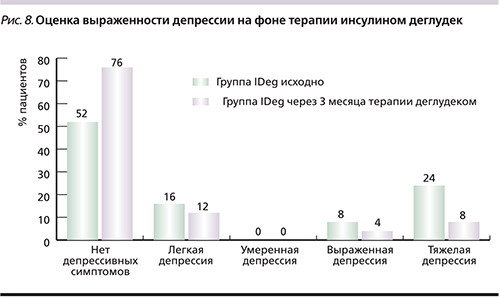
С целью выявления симптомов депрессии психоэмоциональный статус пациентов оценивался по шкале депрессии Бека. Результаты оценивались следующим образом: 0–9 баллов – отсутствие депрессивных симптомов; 10–15 – легкая депрессия; 16–19 – умеренная депрессия; 20–29 – выраженная депрессия; 30–63 балла – тяжелая депрессия. При обработке результатов теста на наличие симптомов депрессии и степени их выраженности у 13 (52%) пациентов группы IDeg и 15 (71,4%) группы IGlar выявлено отсутствие признаков депрессии, умеренная степень депрессии отсутствовала в группе IDeg, хотя число больных тяжелой депрессией исходно в этой группе было больше по сравнению с группой IGlar (табл. 4). Средний балл по опроснику исходно в группе IDeg составил 15,12±13,27 (±SD), в группе IGlar – 9,38±10,46 (±SD).
В динамике на фоне лечения IDeg число пациентов с отсутствием симптомов депрессии через 3 месяца возросло с 52 до 76%, а число пациентов с проявлениями тяжелой депрессии уменьшилось с 24 до 8% (рис. 8). Средняя оценка снизилась с 15,12±13,27 (±SD) до 9,56±10,46 (±SE) балла.
В группе IGlar через 3 месяца лечения значения как оценок отдельных параметров (шкал) опросника, так и суммарный средний балл были сопоставимыми с исходными данными. При проведении корреляционного анализа в группе IDeg выраженность депрессии коррелировала с показателем «сонливость в течение дня» по шкале диагностики гипогликемии (r=0,561, р=0,004). Также были найдены статистически достоверные взаимосвязи между выраженностью депрессии и показателями шкал EQ-5D. «Подвижность» (r=0,445, р=0,002), «Уход за собой» (r=0,461, р=0,002), «Привычная повседневная деятельность» (r=0,420, р=0,005), «Боль» (r=0,624, р<0,001), «Тревога» (r=0,629, р=0,001).
В группе IGlar выраженность депрессии коррелировала с показателями шкал диагностики гипогликемии «Усталость» (r=0,474, р=0,041), «Снижение памяти» (r=0,567, р=0,014), «Проблема с концентрацией внимания» (r=0,584, р=0,014), а также с показателями шкал EQ-5D. «Подвижность» (r=0,644, р=0,003), «Уход за собой» (r=0,562, р=0,012), «Привычная повседневная деятельность» (r=0,462, р=0,046), «Боль» (r=0,501, р=0,029), «Тревога» (r=0,792, р<0,001).
Выводы
Терапия IDeg ассоциировалась с клинически и статистически значимым улучшением гликемического контроля (по HbA1c), немного более выраженным (недостоверно), чем при лечении IGlar. Однако для улучшения контроля гликемии при терапии IDeg требуется меньшая, чем при использовании IGlar, доза базального инсулина (в среднем на 26%).
На фоне применения IDeg было достигнуто существенное снижение числа гипогликемий «средней тяжести» (на 45%), уменьшение слабости и сонливости, согласно опроснику по диагностике гипогликемии. Также отмечено увеличение числа пациентов, с улучшением чувствительности к гипогликемии на фоне проводимой терапиии IDeg.
На фоне применения IDeg отмечено достоверное улучшение оценки общего состояния здоровья (опросник EQ-5D) с 52 до 64 баллов за счет улучшения оценок по шкалам «подвижность» и «тревога/депрессия» (р=0,032), а также увеличение суммарной оценки общего состояния здоровья по данным визуально-аналоговой шкалы – с 51,8 до 64,3 (р=0,04).

На фоне терапии IDeg число пациентов, испытывавших депрессию, согласно оценке по шкале депрессии Бека, достоверно снизилось (на 24%), прежде всего за счет уменьшения депрессии средней тяжести в 2 раза и тяжелой – в 3. Выраженность депрессии коррелировала с оценкой качества жизни по EQ-5D и суммарной оценкой по шкале диагностики гипогликемии (сонливость, усталость, снижение памяти).
Конфликт интересов
М.Ф. Калашникова выступает с лекциями от компаний «Ново Нордиск», «Такеда», а также принимает участие в клинических исследованиях, поддерживаемых компаниями «Ново Нордиск», «Санофи».
А.В. Зилов выступает с лекциями и является членом экспертных советов, поддерживаемых компаниями «Ново Нордиск» и «Санофи».
Д.Р. Языкова, Н.В. Лиходей, В.В. Фадеев декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с написанием данной статьи.
Работа выполнена по инициативе авторов на кафедре эндокринологии ГБОУ ВПО «Первый МГМУ им. И.М. Сеченова» Минздрава России (Москва) при поддержке компании «Ново Нордиск».


