Более века известно, что метаболизм макронутриентов (таких как жиры, белки и углеводы) сильно затруднен при дефиците в организме микронутриентов (ионов металлов, элементоорганических соединений, витаминов). Микронутриенты непосредственно воздействуют на физиологические процессы, т.к. в подавляющем большинстве случаев они являются кофакторами ферментов или же факторами стабилизации пространственных структур белков и РНК. Функционирование сердца и всей сердечно-сосудистой системы практически невозможно без ряда определенных микронутриентов, в частности магния.
В случае магния были проведены крупномасштабные исследования доказательного характера. Например, достаточно давно известна корреляция между смертностью от сердечно-сосудистых заболеваний и уровнями магния в питьевой воде. Сравнительно недавнее шведское исследование, включившее 1679 пациентов, показало, что риск смерти от инфаркта миокарда был ниже в группе с высокими уровнями магния в плазме крови (>0,83 ммоль/л), чем в группе с меньшими его уровнями (<0,75 ммоль/л). Риск смерти от острого инфаркта миокарда по отношению к содержанию магния в питьевой воде составил 0,64 (95% доверительный интервал [ДИ] – 0,42–0,97) для группы с самым его высоким содержанием.
Изучение когорты 5511 из участников 28–75 лет без артериальной гипертензии на момент начала исследования, проведенного в течение 8 лет, показало, что риск гипертензии (систолическое артериальное давление [САД] ≥140 мм рт.ст. или диастолическое артериальное давление [ДАД] ≥90 мм рт.ст.) снижался с увеличением уровня магния в суточной моче. Более высокие уровни магния в моче указывают на более высокое его потребление с пищей и препаратами. Увеличение уровня магния на каждые 2 ммоль приводило к снижению риска артериальной гипертензии на 21% (отношение шансов [ОШ] – 0,79; 95% ДИ – 0,71–0,88).
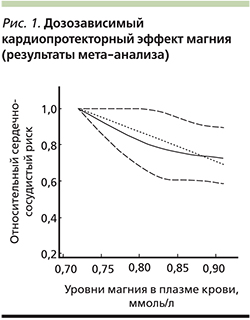 Мета-анализ проспективных когортных исследований суммарно включил 532 979 участников из 19 исследований, в т.ч. 19 926 случаев установленной сердечно-сосудистой патологии. Сравнение подгрупп с самым высоким и самым низким уровнями потребления магния с пищей показало, что у участников 1-й подгруппы риск сердечно-сосудистых заболеваний снижался в среднем на 15% (ОШ – 0,85; 95% ДИ – 0,78–0,92; рис. 1). Группировка пациентов в соответствии с уровнями магния в плазме крови указала на снижение риска при его высоких концентрациях на 23% (ОШ – 0,77; 95% ДИ – 0,66–0,87). Подтвержденный кардиопротекторный эффект магния был дозозависимым – увеличение уровня магния в плазме крови на 0,2 ммоль/л соответствовало снижению риска сердечно-сосудистой патологии в среднем на 25% (рис. 1).
Мета-анализ проспективных когортных исследований суммарно включил 532 979 участников из 19 исследований, в т.ч. 19 926 случаев установленной сердечно-сосудистой патологии. Сравнение подгрупп с самым высоким и самым низким уровнями потребления магния с пищей показало, что у участников 1-й подгруппы риск сердечно-сосудистых заболеваний снижался в среднем на 15% (ОШ – 0,85; 95% ДИ – 0,78–0,92; рис. 1). Группировка пациентов в соответствии с уровнями магния в плазме крови указала на снижение риска при его высоких концентрациях на 23% (ОШ – 0,77; 95% ДИ – 0,66–0,87). Подтвержденный кардиопротекторный эффект магния был дозозависимым – увеличение уровня магния в плазме крови на 0,2 ммоль/л соответствовало снижению риска сердечно-сосудистой патологии в среднем на 25% (рис. 1).
Таким образом, с точки зрения результатов клинических исследований и т.н. доказательной медицины кардиопротекторный эффект магния не подлежит сомнению. С точки зрения физиологии систем при недостатке магния сердечная мышца становится неспособной выдерживать значительную физическую нагрузку, быстрее изнашивается, что приводит к инфаркту вследствие физической перегрузки миокарда. Магний поддерживает энергетические и пластические процессы, стабилизирует уровень АТФ, участвует в окислении жирных кислот, гликолизе и биосинтезе белка, синтезе оксида азота в эндотелии сосудов и др. Магний также является физиологическим регулятором возбудимости клетки и совершенно необходим для нормального функционирования процессов деполяризации нервных и мышечных клеток.
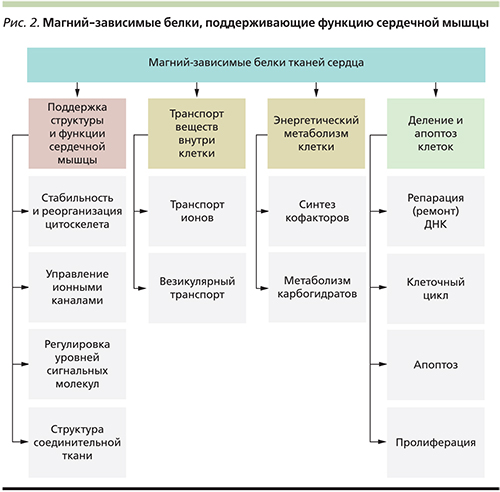
Магний-зависимые белки, поддерживающие функцию сердечной мышцы
Известно, что уровни магния значительно влияют на сократимость миокарда и дефицит этого минерала приводит к ослаблению сердечной функции и аритмиям. Например, исследование эффектов длительного магниевого голодания у крыс (8 недель на диете, обедненной магнием) показало снижение содержания внутриклеточных адениннуклеотидов, повышенный уровень креатинфосфата и уменьшение силы сокращений миокарда без изменения частоты пульса. Эти и другие последствия дефицита магния опосредуются рядом магний-зависимых белков, непосредственно влияющих на функцию сердечной мышцы. Эти белки можно подразделить на ферменты, регулирующие уровни сигнальных молекул, магний-зависимые белки, управляющие потоком катионов через мембраны, и белки, поддерживающие цитоскелет мышечных клеток (рис. 2).
В целом в магний-зависимое регулирование состояния соединительной ткани вовлечены по меньшей мере 20 белков. Возможные механизмы влияния дефицита магния на синтез и деградацию соединительной ткани включают активацию матриксных металлопротеиназ, лизилоксидазы, глутаминазы, замедление синтеза коллагена, эластина и гиалуронана, а также снятие ингибирования магнием металлопротеиназ и гиалуронидаз, деградирующих соединительную ткань.
При дефиците Mg2+ белковый синтез соединительной ткани замедляется, активность металлопротеиназ увеличивается и внеклеточный матрикс прогрессивно деградирует, т.к. структурная поддержка ткани (в частности, коллагеновые волокна) разрушается быстрее, чем синтезируется. На структуру соединительной ткани (в частности, хряща) могут также оказывать влияние магний-зависимые белки сигнальных путей пролиферации клеток и прежде всего рецептор активина типа 2B (ACVR2B), активирующий SMAD-транскрипционные регуляторы, что приводит к активации фибробластов и ускорению заживления ран.
«Энергетический метаболизм» является достаточно широким понятием, включающим анаболические и катаболические процессы со стороны белков, жиров и углеводов, в конечном итоге приводящие к накоплению резерва клеточного АТФ, этой универсальной молекулы энергопереноса в биологических системах. Всего лишь 1 мМ ионов магния находится в организме в свободном состоянии, остальная часть биометалла связана с белками и растворимыми соединениями, такими как АТФ, миозин скелетной мышцы, тропонин-С миокарда, аминокислотами (в частности, с глицином, аланином, аспарагиновой кислотой и т.д.) и различными ферментами. Взаимодействия магния с АТФ наиболее важны для энергетического метаболизма: Mg2+ стабилизирует молекулу АТФ путем нейтрализации избыточного отрицательного заряда фосфатов.
В дополнение к влиянию на взаимодействие магния с АТФ, имеющее важное значение для энергетического метаболизма, дефицит магния также негативно сказывается на функционирование многих белков сердечно-сосудистой системы, которые поддерживают энергетический метаболизм и требуют магний в качестве кофактора.
Эти магний-зависимые белки участвуют в синтезе важных коферментов, в метаболизме углеводов (в частности, в гликолизе), а в митохондриях они задействованы в метаболизме пирувата и жирных кислот. Понижение активности этих ферментов (прежде всего гликолитических) является наиболее вероятным объяснением формирования инсулинорезистентности.
О терапевтическом применении органических солей магния
Магний оказывает разностороннее воздействие на метаболизм, структуру и функцию сердца и всей сердечно-сосудистой системы. Принимая во внимание, что частота встречаемости дефицита магния в различных популяциях составляет 30–50%, становится очевидным, что у значительного числа кардиологических больных он наблюдается в той или иной степени. Соответственно, многие из описанных выше молекулярных функций будут замедлены, что приведет к большей восприимчивости к неблагоприятным сердечно-сосудистым событиям. Восстановление функционального состояния сердечной мышцы также будет затруднено при дефиците магния (вследствие дисбаланса апоптоза и пролиферации, ослабленной структуры соединительной ткани и т.д.).
Помимо непреходящей роли магния в физиологии сердечно-сосудистой системы существует другая сторона вопроса в отношении фармакологической коррекции дефицита магния – биодоступность магния в различных препаратах. Наилучшей биодоступностью обладают натуральные источники магния – овощи, фрукты, орехи и т.д. Однако восполнение его дефицита при заболеваниях сердечно-сосудистой системы не может проводиться только за счет коррекции диеты. Фармакологическая поддержка магниевыми препаратами необычайно важна. Препараты неорганического магния, такие как магния сульфат, характеризуются крайне низкой его биодоступностью и рядом выраженных побочных эффектов. Использование в магниевой фармакотерапии препаратов второго поколения, основанных на органических солях магния и обладающих высокой биодоступностью, намного более перспективно. Одним из таких препаратов является оротат магния – соль магния и оротовой кислоты. Оротовая кислота – один из продуктов биосинтеза пиримидинов.
В фармакологии соли оротовой кислоты используются в качестве переносчика минералов, т.к. оротовая кислота повышает клеточную биодоступность катионов и имеет ряд дополнительных преимуществ перед неорганическими солями. Например, оротат магния не вступает в реакцию с кислотой желудка и не оказывает слабительное действие. Показана эффективность оротата магния при состояниях, сопровождающихся дефицитом магния, в т.ч. у больных, подвергшихся коронарным хирургическим вмешательствам. Он оказывает антиаритмическое, сосудорасширяющее и кардиопротективное воздействия. Повышая устойчивость миоцитов к ишемии, оротат магния благоприятно влияет на клиническое течение инфаркта миокарда и сердечной недостаточности.
Эксперименты показывают, что оротовая кислота и оротат магния способствуют улучшению липидного профиля плазмы крови (соотношение липопротеидов низкой и высокой плотности). Действие оротовой кислоты на липиды опосредовано, вероятнее всего, также пуринергическими рецепторами, которые действуют на транскрипцию многих генов с помощью фосфорилирования транскрипционного регулятора CREB.
Результаты клинического применения оротата магния подтверждают результаты фундаментальных исследований. Исследование 79 больных тяжелой сердечной недостаточностью, получавших лечение оротатом магния, показало, что их однолетняя выживаемость составила 76% по сравнению с 52% в группе плацебо. Использование оротата магния увеличивает переносимость физических нагрузок у больных ишемической болезнью сердца (ИБС). Прием препарата пожилыми пациентами с ИБС улучшал параметры качества жизни и психоэмоционального статуса. Позитивное влияние оротата магния в этих случаях может быть связано с вазодилатацией и повышением энергетического метаболизма кардиомиоцитов. С физиологической точки зрения совместное применение магния и оротата является синергичным. На практике показано, что применение оротата магния в комплексной терапии имеет положительный эффект на выживаемость и качество жизни пациентов с ИБС.
В случае идиопатического пролапса митрального клапана (ПМК), который часто рассматривается как разновидность дисплазии соединительной ткани, положительный эффект оротата магния обеспечивается не только через вазодилатацию и улучшение энергетического метаболизма, но и за счет структурных изменений соединительной ткани. Систематическое использование оротата магния оказалось эффективным при лечении пациентов с синдромом соединительнотканной дисплазии сердца (в частности, с ПМК и аномальными chordae tendineae). Исследование 144 пациентов с идиопатическим ПМК показало, что использование оротата магния приводило к снижению максимального САД и ДАД, а также среднего ДАД, уменьшению числа эпизодов тахикардии. Шестимесячная терапия оротатом магния полностью или частично купирует симптомы ПМК более чем у половины пациентов.
Цитрат магния – одна из органических солей, используемых для изготовления современных магний-содержащих препаратов. Поскольку цитрат является органической и хорошо растворимой формой магния, это в значительной степени обусловливает его высокую биоусвояемость. Однако хорошая растворимость в воде – далеко не единственная особенность цитрата магния, который также характеризуется рядом специфических молекулярных эффектов. Это участие магния в качестве центрального субстрата цикла Кребса (который даже имеет альтернативное название – «цитратный цикл»), взаимодействие с белками – транспортерами дикарбоксилатов и наконец эффекты, обусловленные физико-химическими особенностями самой молекулы цитрата. Следует подчеркнуть, что все метаболиты цитрата – эссенциальные эндогенные молекулы. Практически полная утилизация цитрата (превращение в углекислый газ и воду) делает его идеальным переносчиком магния.
Анализ литературы по медицинскому применению препаратов цитрата магния показывает, что он применяется в терапии более 50 лет и используется для профилактики образования почечных камней (25 исследований), при лечении и профилактике гипомагнезиемии и гипокалиемии (8), при сосудистых заболеваниях (5) и в акушерстве (4 исследования). Другие медицинские показания к применению цитрата магния (3 исследования) включают нормализацию минеральной плотности костной ткани, лечение синдрома беспокойных ног и бронхиальной астмы.
К механизмам молекулярных функций магний-зависимых белков тканей сердца относятся, в частности, управление ионными каналами, регулировка уровней сигнальных молекул, гликолиз, везикулярный транспорт, внутриклеточная сигнализация от цитокинов, влияние на метаболизм соединительной ткани, апоптоз и деление клеток. Сформулированная обобщенная картина влияния магния на сердечно-сосудистую систему на молекулярном уровне указывает на множественные механизмы, через которые осуществляется терапевтическое воздействие препаратов органического магния у кардиологических больных. Восполнение дефицита магния посредством пищевых добавок или правильно сбалансированной диеты будет способствовать восстановлению нормального функционирования данных молекулярных каскадов, оказывая таким образом положительное влияние на сердечно-сосудистую систему. В целом магний положительно воздействует на энергетический метаболизм, структуру соединительной ткани и сосудистый тонус, способствуя уменьшению уровня катехоламинов в плазме.



