Артериальная гипертензия (АГ) остается одной из наиболее значимых медико-социальных проблем в Российской Федерации. Распространенность АГ среди населения России достигает 39,5 % [1], а среди населения Республики Татарстан, по результатам исследования ЭПОХА-АГ, составляет 32,4 % [2]. Большинством авторов АГ определяется как мультифакториальное заболевание, в развитии которого имеют значение как генетические, так и средовые факторы. По теории Постнова Ю.В., в основе АГ лежат обнаруженные в клетках возбудимого и невозбудимого типов генетически обусловленные структурно-функциональные особенности клеточных мембран, проявляющиеся в изменении скорости пассивного транспорта ионов и повышении уровня свободного кальция цитоплазмы [3]. Критерием оценки данной характеристики служит скорость Na+–Li+-противотранспорта (НЛП) в мембране эритроцита [4].
Важную роль в развитии АГ играет нарушение процессов адаптации [5], уровень которой определяет вегетативная нервная система (ВНС) [6]. Степень адаптационных возможностей, как известно, связана с особенностями формирования генетически детерминированных нейрохимических интеграций, осуществляющихся при участии клеточных мембран [7]. Повышение активности симпатического и угнетение парасимпатического отделов ВНС являются одними из патогенетических механизмов возникновения и становления АГ [8]. Преобладание симпатической активности приводит к нарушению естественной суточной циркадности артериального давления (АД) [9, 10]. Недавние исследования показали прогностическую значимость недостаточного ночного снижения АД в формировании поражения органов-мишеней больных АГ, повышении риска осложнений АГ, развитии хронической сер-
дечной недостаточности и повышении смертности [11, 12].
В связи с этим представляется весьма интересным изучение вегетативного реагирования в контексте ассоциативности структурно-функционального состояния клееночных мембран и формирования суточного профиля АД.
С этой целью были изучены особенности вегетативного реагирования у больных АГ с различными типами суточного профиля АД в диапазонах скорости НЛП в мембране эритроцита.
Материал и методы
Были обследованы 95 больных АГ I–II стадий в возрасте от 18 до 55 лет, средний возраст – 39 ± 3 года. Всем больным проведено суточное мониторирование АД (СМАД). Регистрация АД выполнена по стандартной методике с интервалами 15 минут в дневное и 30 минут в ночное время с последующим вычислением суточного индекса (СИ). Для определения суточного профиля АД рассчитывали показатель степени ночного снижения АД (СНС АД): нормальная (оптимальная) СНС АД (диппер) – СИ 10–20 %; недостаточная СНС АД (нон-диппер) – 0 < СИ < 10 %; повышенная СНС АД (овер-диппер) – СИ > 20 %; устойчивое повышение ночного АД (найтпикер) – СИ < 0.
Анализ вариабельности ритма сердца (ВРС) проведен с использованием трехканального аппарата для суточного мониторирования ЭКГ “Кардиотехника-4000” фирмы Инкарт (Санкт-Петербург). Регистрировались показатели ВРС в покое и на первой минуте ортостаза. Оценивались показатели мощности, определенные в мс2, высокочастотной (HF) составляющей спектра (0,15–0,4 Гц), отражающей интенсивность парасимпатических влияний, низкочастотной (LF) составляющей спектра (0,04–0,15Гц) – указывающей на выраженность симпатических влияний, и очень низкочастотной (VLF) составляющей спектра (0,003–0,04Гц), природа которой связана с гуморальными влияниями [13].
Исходный вегетативный тонус (ИВТ) у больных ГБ определен по соотношению вклада составляющих спектра после 10 минут покоя в положении лежа. Было выделено четыре типа ИВТ: ненапряженный вегетативный баланс (ННВБ; LF > VLF < HF), напряженный вегетативный баланс (НВБ; VLF > LF < HF), симпатикотония (СТ; VLF > HF < LF) и относительная ваготония (ВТ; LF < VLF > HF). Вегетативная реактивность (ВР) оценена по ВРС на 1-й минуте ортостаза как симпатикотоническая (адаптивная реакция), гиперсимпатикотоническая и асимпатикотоническая (дезадаптивные типы ВР) [6]. Функциональное состояние клеточных мембран оценено по скорости НЛП в мембране эритроцита, определенной по методу Сanessa M. (1980). Метод заключается в измерении обмена внутриклеточного лития в “загруженных” этим ионом клетках на внеклеточный натрий и магний из среды инкубации. По скорости НЛП больные группировались в квартили. Границы квартилей распределения величин скорости НЛП для русско-татарской популяции, по данным ранее проведенных исследований, следующие: I квартиль – до 203 мкмоль Li/л кл в час, II квартиль –204–271 мкмоль Li/л кл в час, III квартиль – 272–345 мкмоль Li/л кл в час, IV квартиль – более 346 мкмоль Li/л кл в час [14]. Статистическая обработка проведена на персональном компьютере при помощи программы Microsoft Exсel 7.0 и пакета прикладных программ Statistika 6.0.
Результаты и их обсуждение
В соответствии со скоростью НЛП все обследуемые были отнесены к четырем квартилям. В I квартиле оказалось 17 больных, во II – 26, в III – 21 и в IV – 31. Распределение больных АГ с различными типами суточного профиля АД в квартилях скорости НЛП представлены в табл. 1. В связи с малым числом больных с суточным профилем типа овер-диппер провести корректный статистический анализ в этой группе не представлялось возможным.
Таблица 1. Частота распределения больных в квартилях скорости НЛП в зависимости от суточного профиля АД (%).
Анализ значений ИВТ выявил преобладание СТ у большинства больных АГ с любым суточным профилем АД вне зависимости от скорости трансмембранного транспорта ионов. Так, у дипперов СТ колебалась от 80 % во II квартиле скорости НЛП до 100 % в I, III и IV квартилях, а у нон-дипперов – от 72 % в IV квартиле до 100 % в I–III квартилях НЛП. ННВБ наблюдался у 20 % дипперов во II квартиле и у 28 % нон-дипперов в IV. В то же время функциональной нагрузочной пробой определено отсутствие у больных АГ синергизма парасимпатических реакций на фоне снижения общей мощности спектра во всех квартилях скорости НЛП (табл. 2).
Таблица 2. Динамика показателей спектрального анализа ВРС у больных АГ (мс2).
Установлено существенное различие профилей HF и LF по шкале НЛП у больных с различными суточными профилями АД. В случае нормального профиля АД наблюдается снижение мощности в диапазонах частот, в то время как при недостаточном ночном снижении АД мощности частот имеют свои максимальные значения при высоких скоростях НЛП. При этом анализ спектрального состава ВРС в покое показал, что мощность HF у больных АГ с суточным профилем АД типа нон-диппер в IV квартиле демонстрирует наибольшие значения в сравнении с больными с профилем АД типа диппер (128 ± 27 и 63 ± 8 мс2 соответственно). При сравнении показателей LF во II квартиле выявлена достоверно большая мощность у больных АГ с суточным профилем АД типа диппер в сравнении с больными с суточным профилем АД типа нон-диппер (362 ± 68 и 122 ± 21 мс2 соответственно; p = 0,026), а в IV квартиле у больных с суточным профилем АД типа диппер мощность низкочастотной составляющей спектра оказалась ниже, чем у больных с суточным профилем АД типа нон-диппер, но в данном случае, как и в I квартиле, выявленная тенденция не достигла уровня достоверности (рис. 1). Примененный метод ранговой корреляции Спирмена продемонстрировал у больных АГ с суточным профилем типа диппер обратную связь средней силы между скоростью НЛП и уровнем мощности низкочастотного
компонента спектра (rs = -0,46, p < 0,05).
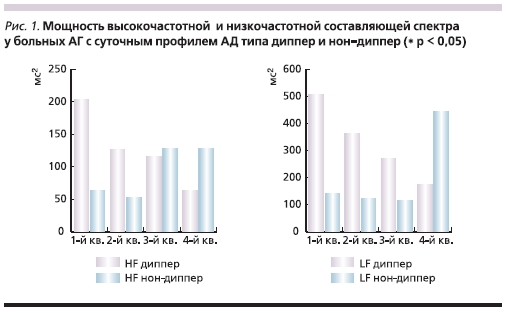
Большой интерес представляет дифференцированный анализ больных АГ с суточными профилями АД типа диппер и нон-диппер с определением различий вегетативных паттернов. У дипперов, как и у всех больных АГ, выявляется недостаточность парасимпатических реакций. Первый квартиль характеризуется асимпатикотоническим типом ВР при проведении ортостатической пробы. Во всех остальных квартилях наблюдался умеренный симпатикотонический тип реагирования с нарастанием реакции LF к IV квартилю. Больные АГ с суточным профилем АД типа нон-диппер имели те же тенденции, что и больные с суточным профилем типа диппер, но в целом на меньшем уровне мощности
HF, LF и общей мощности спектра частот (табл. 3). При этом амплитуда реакции на ортостаз характеризовалась гиперсимпатикотонической реактивностью во II и особенно в III квартилях, где наблюдалось чрезмерное повышение абсолютных значений мощности очень низкочастотной (с 381 ± 70 до 1019 ± 380 мс2; p < 0,05) и низкочастотной составляющей спектра (с 163 ± 42 до 735 ± 324 мс2; p < 0,05), а также значительное повышение вагусной реактивности (рис. 2), а в IV квартиле – асимпатикотонической реактивностью. Таким образом, больные АГ с суточным профилем АД типа нон-диппер со средней и умеренно высокой скоростью НЛП характеризуются чрезмерностью ответа на функциональную нагрузочную пробу, что позволяет говорить об этой группе, как о больных АГ с наиболее дезадаптивным типом ВР.
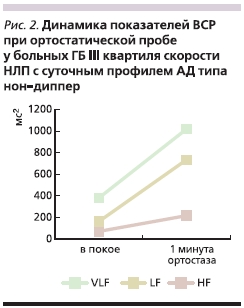
Результаты данного исследования показали особенности симпатической и парасимпатической активности ВНС, отличие в характере вегетативных реакций при функциональной нагрузочной пробе у больных АГ с различными суточными профилями АД. Выявленная корреляционная связь исходного уровня симпатической активности со скоростью трансмембранного транспорта ионов у больных АГ с суточным профилем АД типа диппер и ассоциация дезадаптивного типа ВР с умеренно высокой скоростью НЛП у больных с суточным профилем АД типа нон-диппер свидетельствуют о значительном влиянии функционального состояния клеточных мембран на формирование характерного вегетативного статуса у больных АГ с соответствующим суточным профилем АД.
Таблица 3. Динамика показателей спектрального анализа ВРС при проведении ортопробы у больных ГБ с различными суточными профилями АД в квартилях скоростями НЛП (мс2).
Выводы
Исходный вегетативный тонус и вегетативная реактивность больных АГ ассоциированы с функциональным состоянием клеточных мембран.
Уровень активности симпатического отдела вегетативной нервной системы у больных АГ с нормальным ночным снижением АД обратно коррелирует со скоростью трансмембранного ионотранспорта.
Больные АГ с нормальной степенью ночного снижения АД при высокой скорости трансмембранного ионотранспорта и с недостаточным ночным снижением АД при средней скорости НЛП продемонстрировали более адаптивную реакцию на ортостатическую пробу.
Гиперсимпатикотонический тип вегетативной реактивности характерен для больных АГ с недостаточным ночным снижением АД и умеренно высокой скоростью трансмембранного транспорта ионов. Для этой категории больных в целом характерен наиболее дизрегуляторный тип вегетативного гомеостаза вне зависимости от мембранных характеристик.


