Введение
Ежегодно в мире регистрируется 1,2 млн новых случаев рака легкого, из них до 60 % приходится на развитые страны. Рак легкого остается лидирующей причиной смерти от онкологических заболеваний в мире [1, 2]. Мужчины болеют значительно чаще, чем женщины. В России абсолютное число умерших от рака легкого увеличилось за 20-летний период на 40 %. На долю немелкоклеточного рака
легкого (НМРЛ) приходится примерно 85 % всех случаев рака легкого [3].
Практически все больные НМРЛ на разных этапах лечения нуждаются в лекарственной терапии [4]. Как показали многочисленные исследования, комбинированная платиносодержащая химиотерапия позволяет увеличивать продолжительность жизни, улучшать контроль симптомов заболевания и качество жизни пациентов с НМРЛ. Применение таких препаратов, как пеметрексед, доцетаксел, паклитаксел и гемцитабин вместе с цисплатином, увеличивает частоту объективных ответов и общую выживаемость относительно более старых комбинаций. Однако достигаемое преимущество крайне незначительно, а общая выживаемость не превышает 8–10 месяцев
[5, 6].
Успехи лекарственного лечения больных диссеминированным НМРЛ в начале XXI в. связаны прежде всего с развитием молекулярной медицины, выделением ряда молекулярно-биологических характеристик опухоли, предсказывающих чувствительность к лекарственной терапии. Внедрение достижений молекулярной онкологии в практическое здравоохранение привело к созданию новых противоопухолевых т. н. молекулярно-ориентированных или таргетных препаратов, воздействующих на определенные, заранее установленные внутриклеточные молекулярные мишени, имеющие ключевое значение для жизнедеятельности опухолевой клетки. Основной мишенью таргетной терапии НМРЛ является рецептор эпидермального фактора роста (EGFR – epidermal growth factor receptor), участвующий в регуляции клеточного роста и дифференцировке клеток. В большинстве случаев рака
легкого наблюдается гиперэкспрессия или гиперактивация EGFR. Одним из классов таргетных препаратов, подавляющих активность этого рецептора, являются низкомолекулярные тирозинкиназные ингибиторы (ТКИ) EGFR гефитиниб и эрлотиниб, одобренные с целью лечения диссеминированного НМРЛ [7].
На сегодняшний момент большое внимание также уделяется изучению факторов роста эндотелия VEGF и тирозинкиназных рецепторов VEGFR, которые являются связующим звеном в реализации проангиогенных эффектов в клетке. VEGF передает сигналы главным образом через рецептор VEGFR 2, который в большом количестве продуцируется клетками эндотелия в процессе ангиогенеза.
Гиперэкспрессия VEGF обнаружена в большинстве изученных в настоящее время злокачественных опухолей, в т. ч. и опухолях легкого. Первым антиангиогенным препаратом, блокирующим связывание VEGF с его рецепторами, был бевацизумаб – мышиное моноклональное антитело против человеческого VEGF. В рандомизированных клинических исследованиях показано, что добавление бевацизумаба к химиотерапии нелеченых больных распространенным НМРЛ удлиняет время до прогрессирования (6,2 против 4,5 месяца) и улучшает общую выживаемость (12,3 против 10,3 месяца) [19]. Бевацизумаб применяется только при неплоскоклеточном варианте НМРЛ.
В отделении химиотерапии совместно с лабораторией онкогеномики НИИ канцерогенеза ФГБУ “РОНЦ
им. Н.Н. Блохина” РАМН проведено исследование, в котором изучались эффективность и безопасность
ТКИ EGFR эрлотиниба и гефитиниба для пациентов с распространенным НМРЛ.
Материал и методы
В исследование, изучавшее ТКИ, были включены 86 больных неоперабельным или рецидивным НМРЛ,
у которых отмечалось прогрессирование на фоне проведения стандартных режимов химиотерапии. Исключение составили 5 пациентов с тяжелой сопутствующей патологией, имеющие противопоказания к проведению традиционного лекарственного лечения. Таким больным ТКИ назначали в 1-й линии терапии. У 38 из 86 больных образцы опухолевой ткани были доступны иммуногистохимическому (ИГХ) и генетическому исследованиям, для которых использован биопсийный материал опухолевой ткани легкого, полученный от 38 пациентов до начала специфического лечения. Всем 38 больным был проведен анализ мутаций в 19-м и 21-м экзонах гена EGFR и во 2-м экзоне гена KRAS [8–10]. Далее клинические данные были сопоставлены с результатами генетического анализа.
Результаты исследования
Лечение проведено двумя ингибиторами EGFR: гефитинибом в дозе 250 мг и эрлотинибом в дозе 150 мг на ежедневный прием непрерывно до прогрессирования или развития тяжелой токсичности.
Демографические и клинические характеристики больных обобщены в табл. 1.
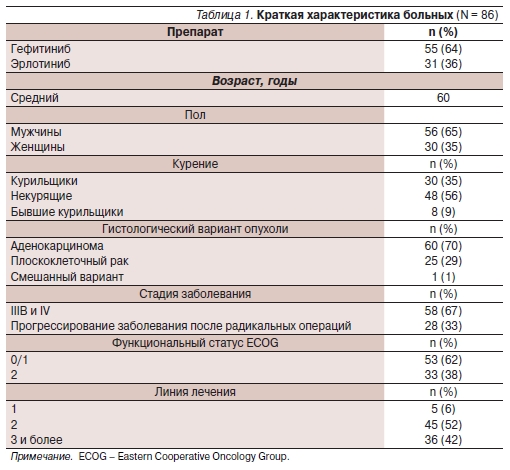
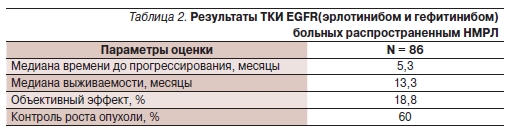
Эффективность лечения оценена для 85 пациентов обеих групп и каждой группы в отдельности. Одна больная умерла через 4 недели после начала приема гефитиниба от легочного кровотечения. Результаты лечения ТКИ представлены в табл. 2.
Нежелательные явления присутствовали в различной степени интенсивности у 65 % больных. Чаще других возникали кожная сыпь (63 %) и диарея (17,4 %). Медикаментозная коррекция диареи лоперамидом потребовалась 5,8 % больных. При этом не было перерыва в лечении и редукции дозы.
Кожная токсичность проявлялась сухостью кожи, зудом, покраснением, сыпью в виде макул и папуло-
пустулезных элементов, а также их сочетанием. Наиболее часто сыпь локализовывалась на верхней половине туловища, лице и волосистой части головы. В большинстве случаев высыпания появлялись на 1-й или 2-й неделе лечения и самостоятельно уменьшались или совсем исчезали через 2–3 месяца приема ТКИ. Иногда требовалась косметическая и/или медикаментозная коррекция кожных проявлений.
Была выявлена зависимость эффективности лечения от наличия кожных проявлений. Объективный эффект (ОЭ) у пациентов с наличием кожной сыпи составил 26 %, у больных без кожной сыпи – 6,2 % (p = 0,02). Медиана времени до прогрессирования (МВДП) у больных, не имевших сыпи, составила 2,7 месяца, тогда как у больных с сыпью достигла 5,6 месяца (p = 0,27). Медиана общей выживаемости (МОВ) имела достоверные различия и составила 6,9 месяца у больных без кожной сыпи и 16,6 месяца у
больных с наличием таковой (p = 0,03). Было выполнено генетическое исследование 38 больных методом микродиссекции парафиновых срезов и выделения опухолевой ДНК. Мутации гена EGFR найдены у 12 больных. Характеристика больных с мутациями EGFR представлена в табл. 3.
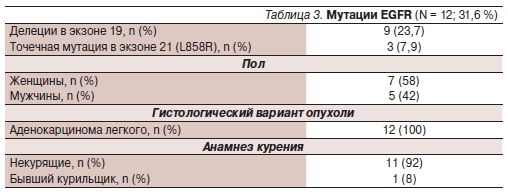
Оценка непосредственной эффективности лечения проведена всем 12 пациентам с мутациями EGFR. Всего было зарегистрировано 1 полная и 4 частичные ремиссии. Стабилизация болезни отмечена у 4 (33 %) больных. Таким образом, ОЭ в этой популяции составил 42 %, контроль роста опухоли (КРО) — 75 %.
Эффективность лечения 26 пациентов с отсутствием мутаций EGFR выглядела следующим образом: ОЭ у 2 (7,7 %) больных – 1 полная и 1 частичная ремиссии. Стабилизация болезни зарегистрирована у 6 (23 %) больных, прогрессирование болезни — у 18 (69,3 %), КРО отмечено у 8 (30,7 %) больных. При сравнительной оценке групп больных с наличием и отсутствием мутаций EGFR различия в группах
достигли статистической значимости в отношении объективного эффекта (p = 0,02), контроля роста опухоли (p = 0,016) и прогрессирования болезни (p = 0,016).
МВДП у пациентов с выявленными мутациями EGFR составила 13,8 месяца, тогда как у больных с отсутствием таковых — 2,7 месяца. Данные различия имеют выраженную тенденцию к статистической значимости (p = 0,05). Больные с наличием мутаций EGFR жили дольше – 21,3 месяца, в то время
как выживаемость больных с отсутствием мутаций составила 6,8 месяца. Однако различия были статистически незначимыми (p = 0,5).
Мутация в экзоне 2-го гена KRAS (миссенс-мутация Gly12) обнаружена у 4 (10,5 %) больных НМРЛ: в 3 аденокарциномах и одном плоскоклеточном раке легкого. У 1 больного найдена как делеция в 19-м экзоне EGFR, так и мутация во 2-м экзоне гена KRAS.
У троих из четверых больных, имеющих в опухоли мутацию KRAS, отмечено прогрессирование заболевания на фоне лечения ингибиторами EGFR. Один больной с сочетанной мутацией EGFR и KRAS лечился с частичным эффектом.
Таким образом, нами отмечена стойкая тенденция к улучшению непосредственных и отдаленных результатов лечения пациентов с распространенным НМРЛ, имеющих в опухоли активирующие мутации EGFR.
Мы также изучали эффективность бевацизумаба в комбинации со стандартными режимами паклитаксел + карбоплатин и гемцитабин + цисплатин для больных диссеминированным неплоскоклеточным НМРЛ, ранее не получавших химиотерапию. Результаты лечения сравнивали с
эффективностью тех же схем химиотерапии без бевацизумаба (группа исторического контроля).
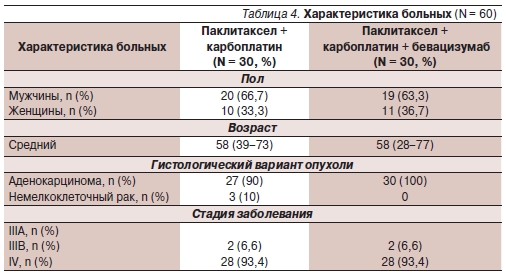
В исследование были включены 135 больных. Характеристика пациентов, получавших в 1-й линии паклитаксел + карбоплатин с или без бевацизумаба, представлена в табл. 4.
ОЭ в группе без добавления бевацизумаба составил 20,0 против 43,3 % для пациентов, получавших химиотерапию в комбинации с бевацизумабом, МВДП составила 4 против 7 месяцев, МОВ – 9,1 против 15,6 месяца соответственно. Различия оказались статистически значимыми для МВДП (p = 0,00036), КРО в группе больных, получавших бевацизумаб, составил 100 %.
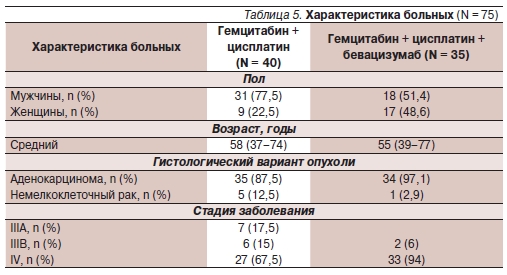
Аналогичный сравнительный анализ был проведен для режима гемцитабин + цисплатин в комбинации с бевацизумабом или без него. Характеристика больных представлена в табл. 5. Объективный эффект составил 24 % при использовании стандартного режима химиотерапии и 47 % при добавлении бевацизумаба, КРО –77 и 93 % соответственно. МВДП была выше в группе с бевацизумабом – 7 против 5 месяцев без добавления бевацизумаба (p = 0,023), МОВ оказалась вдвое больше – 15,8 и 7,8 месяца соответственно (p = 0,00085).
Таким образом, на основании проведенного анализа показано, что добавление бевацизумаба к стандартной химиотерапии паклитаксел + карбоплатин или гемцитабин + цисплатин улучшает общую выживаемость, частоту объективного эффекта и выживаемость без прогрессирования заболевания у больных НМРЛ по сравнению с одной химиотерапией.
Заключение
Мутации гена EGFR следует рассматривать как важный предсказательный фактор эффективности лечения ТКИ EGFR. Полученные нами результаты сопоставимы с таковыми международных исследований [20–23] и убедительно демонстрируют необходимость генетического анализа, позволяющего выделять группу больных, у которых ТКИ EGFR будут наиболее эффективны.
На наш взгляд, стратегия расширения масштабов генетического скрининга позволит повысить частоту
выявления мутаций EGFR. Данный подход особенно оправдан в отношении женщин, некурящих больных и пациентов, страдающих неплоскоклеточными формами НМРЛ.
Наши результаты, полученные при изучении бевацизумаба в комбинации со стандартными режимами химиотерапии, также сравнимы с данными крупных международных рандомизированных исследований [18].
В настоящее время режим паклитаксел + карбоплатин + бевацизумаб является стандартным для 1-й
линии лечения больных диссеминированным неплоскоклеточным НМРЛ.


