За последние годы существенно увеличилось число детей с острыми респираторными вирусными инфекциями, которым ставится диагноз «часто болеющий ребенок». Однако этот диагноз зачастую требует расшифровки [1, 2]. Следует помнить, что под маской острых респираторных заболеваний (ОРЗ) могут протекать иммунодефицитные состояния.
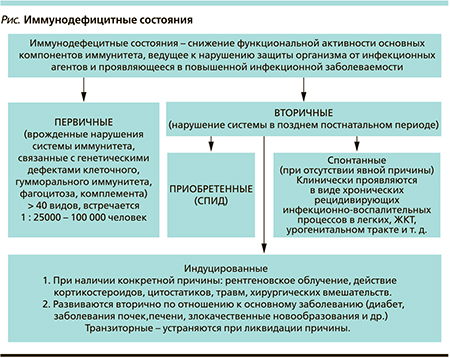
В клинической практике принято различать первичные и вторичные иммунодефициты (см. рисунок). [3]. Первичные иммунодефициты (ИД) – врожденные нарушения системы иммунитета, связанные с генетическими дефектами одного или нескольких ее компонентов, а именно клеточного, гуморального, фагоцитоза, комплемента и т.д. В настоящее время идентифицированы многие десятки врожденных дефектов системы иммунитета. Частота встречаемости первичных ИД соответствует 1 случаю на 23 тыс.–100 тыс. человек. Исключение составляет селективный ИД иммуноглобулина А (IgA), встречающийся с частотой 1 случай на 500–700 человек. Как правило, пациенты с подозрением на первичный ИД обследуются и лечатся в специализированных лечебных учреждениях. Лечение заключается в пожизненном применении иммунозаместительной терапии в комбинации с антибиотиками или без них.
Вторичные ИД – нарушения системы иммунитета, которые развиваются в позднем постнатальном периоде и не служат результатом какого-либо генетического дефекта. Принято выделять три формы вторичных ИД: приобретенную, индуцированную и спонтанную. Наиболее ярким примером приобретенной формы является синдром приобретенного ИД (СПИД). Индуцированные вторичные ИД – это состояния, вызванные конкретной причиной: рентгеновским облучением, действием кортикостероидов, цитостатиков, травмой, хирургическим вмешательством, а также нарушения иммунитета, которые развиваются вторично по отношению к основному заболеванию (диабет, заболевания печени и почек, злокачественные новообразования и пр.). Индуцированные формы вторичного ИД, как правило, транзиторные, и при устранении вызвавшей их причины во многих случаях происходит полное восстановление функции системного иммунитета.
В отличие от индуцированной спонтанная форма вторичного ИД характеризуется отсутствием явной причины, вызвавшей нарушение иммунологической реактивности. Клинически эта форма проявляется в виде хронических рецидивирующих инфекционно-воспалительных процессов бронхолегочного аппарата, урогенитальной системы, желудочно-кишечного тракта, глаз, кожи, мягких тканей, вызванных условно-патогенными микроорганизмами и различными вирусами. По распространенности спонтанная форма доминирует над другими формами вторичного ИД [4].
Оценка системы иммунитета при таких процессах нередко бывает затруднительной. Это связано, во-первых, с трудностью выяснения, что является причиной, а что следствием (нарушения системы иммунитета обусловили возникновение заболевания или возникшее заболевание привело к изменениям иммунологических показателей?); во-вторых, с получением адекватного данному состоянию материала для исследования [3, 5]. Несмотря на очевидные достижения иммунологии, методические возможности иногда остаются весьма ограниченными. Поэтому набор стереотипных методов исследования, используемых в клинической иммунологии, далеко не всегда может удовлетворить потребности клинической медицины. Возможно, с этим связано следующее: клинически отчетливые признаки нарушения системы иммунитета в ряде случаев не подтверждаются результатами иммунологического обследования. Вышеизложенное служит дополнительным обоснованием положения, согласно которому вторичный ИД остается прежде всего клиническим понятием и проявляется хроническими рецидивирующими, вялотекущими и трудно поддающимися обычному лечению инфекционно-воспалительными процессами, порой выявляемыми вне зависимости от изменений иммунологических показателей.
 В педиатрической практике следует различать наличие вторичного ИД и изменения в системе иммунитета, классифицируемые как «поздно стартующий ребенок» [6]. Исследования показали, что у детей наблюдается онтогенетическая последовательность «созревания» различных иммунных факторов. В основном становление системы иммунитета завершается к 12–14 годам, и к этому возрасту количественные и функциональные характеристики иммунитета соответствуют показателям взрослых лиц. Поэтому детей со сниженными уровнями показателей иммунитета без клинических проявлений вторичной иммунной недостаточности следует наблюдать и проводить динамическое мониторирование иммунного статуса.
В педиатрической практике следует различать наличие вторичного ИД и изменения в системе иммунитета, классифицируемые как «поздно стартующий ребенок» [6]. Исследования показали, что у детей наблюдается онтогенетическая последовательность «созревания» различных иммунных факторов. В основном становление системы иммунитета завершается к 12–14 годам, и к этому возрасту количественные и функциональные характеристики иммунитета соответствуют показателям взрослых лиц. Поэтому детей со сниженными уровнями показателей иммунитета без клинических проявлений вторичной иммунной недостаточности следует наблюдать и проводить динамическое мониторирование иммунного статуса.
Современная стратегия использования иммунотропных препаратов детьми без оценки иммунного статуса предусматривает их применение исключительно в профилактических целях:
- при эпидемиологически неблагоприятной ситуации по какому-либо инфекционному заболеванию;
- перед проведением хирургического вмешательства;
- больным СПИДом и ВИЧ-инфицированным;
- при тяжелых онкологических заболеваниях.
Обязательно следует проводить иммуномодулирующую терапию (ИМТ) при длительно протекающих и часто рецидивирующих инфекционных процессах с выявленными иммунными нарушениями. В отношении часто болеющих детей необходимо исключать такие заболевания, как первичная иммунологическая недостаточность, цилиарная недостаточность, пороки развития легких и бронхов, рецидивирующий бронхит, бронхоэктатическая болезнь, гельминтозы, сахарный диабет, муковисцидоз, респираторная аллергия, ЛОР-патология, пороки сердца.
Постановка достоверного клинического диагноза остается основным принципом проведения рациональной ИМТ. Поэтому необходимо различать как эндогенные и экзогенные факторы, приводящие к частой заболеваемости, так и выявленную нозологическую форму болезни. Кроме того, использование ИМТ в отношении часто болеющих детей в большинстве случаев должно проводиться в комплексе с антибиотиками, противовирусными и противогрибковыми препаратами. Особенностью проведения ИМТ следует считать цикличность (многоступенчатость) ее курсов, а также сочетание с немедикаментозными методами иммунореабилитации (курортными и физиотерапевтическими). Количество циклов определяется выраженностью клинических проявлений, степенью иммунных нарушений и может колебаться от 2–3 до 5–6 и более, длительность сочетанной амбулаторно-санаторной помощи составляет не менее 3 лет. Проведение ИМТ детям основано на осуществлении принципов этапности, непрерывности и преемственности ведения больного. Предусматривается последовательное и непрерывное введение иммунотропного средства на всех этапах комплексного лечения больного ребенка: стационар–амбулаторная помощь–санаторий – до полного восстановления показателей и функций всех звеньев иммунитета.
ИМТ должна основываться на индивидуальном подборе и последовательности ее использования. Оптимальным считается применение методов и препаратов, обладающих одной направленностью, но имеющих различные механизмы действия.
Иммуномодуляторы принято различать по их происхождению [7]. Наибольшее распространение в педиатрии нашли иммуномодуляторы микробного и растительного происхождения, интерфероны (ИФН) и их индукторы, а также иммуноглобулины для внутривенного введения [7–9].
Классификация иммуномодулирующих препаратов
1. Препараты микробного происхождения:
Бифиформ, Бифидумбактерин, Пробифор, Линекс, Аципол, Кипацид, Энтерол, Бактисубтил, Бификол, Гастрофарм, Ацилакт, Бронхо-мунал, БЦЖ, Имудон, ИРС-19, натрия нуклеинат, Продигиозан, Рибомунил, Рузам.
2. Препараты растительного происхождения:
Иммунал, Иммунорм, Иммуновит, Эхинабене, Эхинацин ликвидум.
3. Пептидные препараты:
Бестим, Имунофан, Миелопид, Гроприносин, Тимоптин, Тактивин, Тимактид, Тималин, Тимоген, Тимостимулин.
4. Цитокины и препараты на их основе:
4.1. Препараты на основе ИФН:
Бетаферон, Интрон А, Ребиф, Роферон, Авонекс, Интерферон лейкоцитарный человеческий сухой, Интерферон для инъекций, Лейкинферон, Реаферон, Гриппферон, Виферон (свечи), Кипферон (свечи).
4.2. Индукторы ИФН:
Арбидол, Амиксин, Циклоферон, Неовир.
4.3. Препараты на основе интерлейкинов:
Беталейкин, Аффинолейкин, Ронколейкин.
4.4. Препараты на основе фактора некроза опухолей (ФНО):
Хебертранс, Ридостин.
5. Синтетические препараты:
Гепон, Галавит, Глутоксим, Декарис, Изопринозин, Копаксон-Тева, Ликопид.
6. Препараты на основе природных средств:
6.1. Препараты иммуноглобулинов человека (нормальные IgG):
Иммуноглобулин, Биавен В.И., Гамимун Н, Интраглобин, Октагам, Сандоглобин, Эндобулин, Вигам-ликвид.
6.2. Иммуноглобулины, обогащенные антителами класса IgM:
Пентаглобин.
6.3. Специфические (гипериммунные) иммуноглобулины:
Цитотект, Гепатект, Иммуноглобулин человека антистафилококковый.
7. Другие:
Альфетин, Вобензим, Изофон, Реколин, Эстифан.
Исследования последних лет показали, что в ротоглоточном сегменте у часто болеющих детей выявляются следующие возбудители: Streptococcus pneumoniae (25–30 %), Haemophilus influenzae (15–20 %), Moraxella catarralis (15–20 %), Streptococcus pyogenes (2–5 %); представители грамотрицательной микрофлоры, персистенция различных вирусов [9–11]. Все это послужило основанием к использованию бактериальных лизатов с целью увеличения продукции специфических антител, а также стимуляции неспецифических факторов защиты (секреторных IgA, цитокинов, NK-клеток, клеток макрофагально-фагоцитарной системы и др.). Пирогенал и Продигиозан сменили такие препараты, как Бронхо-мунал, Рибомунил, ИРС-19 и Имудон, различающиеся по составу и механизмам действия. Принято различать бактриальные лизаты системного (Бронхо-мунал, Рибомунил) и местного (ИРС-19, Имудон) действий [12–16].

В многочисленных исследованиях установлено, что применение ИРС-19 и Имудона к детям с рецидивирующими риносинуситами, трахеобронхитами, аденоидитами позволяет нормализовывать систему мукозального иммунитета слизистых оболочек верхних дыхательных путей, носа, околоносовых пазух, глотки и повышать устойчивость к вирусным и другим инфекциям, снижая вероятность развития бактериальных осложнений [18, 19]. Среди ЛОР-врачей сформировалось мнение, будто данные местные иммуномодуляторы являются эффективными препаратами в профилактике частых острых респираторных вирусных заболеваний – ОРВИ [20]. Вместе с тем данные экспериментальных работ свидетельствуют, что в ряде случаев недостаточное воздействие местных иммуномодуляторов может быть связано со следующими причинами: время контакта препаратов со слизистыми оболочками коротко, слизистые оболочки захватывают незначительную часть антигенных субстанций, т.к. время воздействия недостаточное, ротоглоточный сегмент является частью пищеварительного тракта, поэтому здесь не функционирует реснитчатый эпителий, слюна постоянно омывает эту область, мешая постоянному контакту препарата с клетками; отсутствуют данные о времени воздействия местных бактериальных лизатов [21]. Аналогичные результаты были получены в отношении местной терапии антибиотиками, которые подтверждают эффективность использования антибиотиков местной терапии только для лечения отитов. Поэтому наибольшее распространение в педиатрической практике получили бактериальные лизаты системного действия. Хороший эффект получен от применения Бронхо-мунала. С учетом однонаправленности действия местных и системных бактериальных лизатов естественно ставить вопрос о возможности их совместного применения. Такой опыт есть, однако в связи с неоднозначностью полученных результатов исследования в этом направлении следует расширять.
 В настоящее время сложилась ситуация, свидетельствующая о неоправданно широком использовании антибиотиков в отношении часто болеющих детей, что приводит к дисбиотическим реакциям ротоглоточного сегмента, а в некоторых случаях и полному отсутствию облигатной микрофлоры.
В настоящее время сложилась ситуация, свидетельствующая о неоправданно широком использовании антибиотиков в отношении часто болеющих детей, что приводит к дисбиотическим реакциям ротоглоточного сегмента, а в некоторых случаях и полному отсутствию облигатной микрофлоры.
В свете этих данных уместно высказать гипотезу, будто бактериальные лизаты возмещают недостаток стимуляции, связанной с бактериальной инфекцией, и оказывают положительное адаптогенное воздействие на иммунную систему.
Особое место среди иммуномодуляторов бактериального происхождения занимают рибосомально-протеогликановые комплексы (Рибомунил), обладающие комбинированным действием. С учетом того что рибосомальные иммуномодуляторы не только активируют факторы неспецифической защиты (мактофаги, ИФН), но и способствуют формированию специ-фического, преимущественно местного, иммунитета слизистых оболочек, их относят к мукозальным вакцинам [20].
Рибомунил содержит рибосомы Klebsiella pneumoniae, S. pneumoniae, S. pyogenes, H. influenzae, а также протеогликаны мембранной части K. pneumoniae. Входящие в его состав рибосомы содержат антигены, идентичные поверхностным антигенам бактерий и при попадании в организм вызывают образование специфических антител к этим возбудителям. Мембранные протеогликаны стимулируют неспецифический иммунитет, что проявляется в усилении фагоцитарной активности макрофагов и полинуклеарных лейкоцитов, повышении факторов неспецифической резистентности. Препарат стимулирует функцию Т- и И-лимфоцитов, продукцию сывороточных и секреторных иммуноглобулинов типа IgA, интерлейкина-1, а также интерферонов-a и -γ.
Эффективность Рибомунила изучали на 48 детях с хроническими и рецидивирующими болезнями легких (42 ребенка с врожденными пороками развития легких и 6 детей с хронической пневмонией). К часто болеющим были отнесены 28 (58 %) детей. Число обострений бронхо-легочного процесса варьировалось от 3 до 4 раз в год, частота ОРВИ колебалась от 4 до 6 раз в год. Группу сравнения составили 14 детей с врожденными пороками развития легких, не получавших Рибомунил. Клинический и иммунологический эффекты от приема Рибомунила оценивали через 6 месяцев от начала применения. У 32 (66 %) детей имело место снижение частоты и длительности ОРВИ за период наблюдения, а также уменьшение частоты обострений.
Найден ряд экспериментальных и клинических данных, в которых показан хороший локальный ответ препарата на уровне слизистых оболочек. В связи с этим при оценке действия Рибомунила оценивали показатели мукозального иммунитета: sIgA1, sIgA2 и интерлейкина-8 (ИЛ-8).
Как показало проведенное исследование, в обеих группах отмечена выраженная положительная динамика уровня sIgA2 в виде его повышения (табл. 1).
В исходном уровне ИЛ-8 в аспирате из дыхательных путей как в контрольной группе, так и в группе сравнения статистически значимого различия отмечено не было. Через 6 месяцев в обеих группах имело место увеличение уровня исследуемого цитокина, однако статистически значимого различия в обеих группах не выявлено (табл. 2).
Позитивное воздействие Рибомунила в виде увеличения sIgA2 в слюне свидетельствует об активации мукозального звена местного иммунитета. Изменения в местном иммунитете на фоне применения Рибомунила сопровождались клиническим эффектом в 66,7 % случаев в виде снижения частоты и длительности интеркуррентных ОРЗ в 1,6 раза. Побочных реакций при применении Рибомунила не отмечено. Таким образом, клинико-иммунологические результаты исследования свидетельствуют о целесообразности применения Рибомунила детьми с хроническими воспалительными заболеваниями легких в качестве профилактического средства уменьшения обострений заболевания.
С возрастом у детей появляются антитела все к большему числу вирусов, что приводит к снижению инфекционной заболеваемости. Не уменьшая значимости вакцинации, для профилактики ОРЗ используются растительные адаптогены (Иммунал, Иммунап, Иммунорм), а также препараты ИФН (Виферон, Гриппферон) и его индукторы (Арбидол, Амиксин). Клинические исследования показали, что использование этих иммуномодуляторов эффективно также в остром периоде ОРВИ, но не позже, чем в первые 24 часа заболевания (до момента попадания вируса в клетку), при этом уменьшается выраженность клинических проявлений и более быстрое обратное развитие заболевания.
У пациентов с аллергией имело место переключение иммунного ответа на Th1-ответ. Очевидно, этот результат основан на более выраженной модуляции различных иммунологических механизмов, что более физиологично и лишено излишней агрессии.
Максимально оправданным для детей, часто болеющих ОРВИ, следует считать использование иммуномодуляторов растительного происхождения, в основе которых лежит сок травы Echinacea. Широкое применение Иммунала как препарата Echinacea в педиатрии базируется на данных экспериментальных работ, в которых была доказана возможность препарата стимулировать процессы фагоцитоза, антигензависимую пролиферацию Т-лимфоцитов, увеличивать синтез ФНО-α, пропердина, ИФН-α, -β и т.д. [13]. Доказано противомикробное действие Иммунала в отношении ряда возбудителей (Escherichia coli, Proteus mirabilis, Pseudomonas aeruginosa, Staphilococcus aureus) и различных вирусов (герпес, цитомегаловирус, вирус Эпштейна–Барр и др.) [3]. С учетом адаптогенной направленности действия препаратов на основе Echinacea в отношении факторов иммунной системы, т.е. сбалансированного, приближенного к физиологическому, комплексного (табл. 2), затрагивающего практически все эффекторные иммунологические механизмы и лишенного побочных эффектов, Иммунал используется в большей степени как профилактическое средство. Доказанной эффективностью Иммунала является сокращение сроков течения респираторно-вирусных заболеваний, уменьшение интоксикации и лихорадки [15]. Кроме того, ИМТ с использованием препаратов Echinacea позволяет снижать частоту бактериальных осложнений ОРВИ [16]. Снижение частоты случаев ОРВИ было зафиксировано при применении Иммунала пациентами с заболеваниями кожи (экзема, псориаз), инфекциями мочевыводящей системы, аутоиммунными и другими заболеваниями [17]. Очевидно, этот результат основан на способности растительных иммуномодуляторов вызывать неспецифический ответ по отношению к различным респираторным вирусам [8, 12]. Скорее всего, имеет значение увеличение синтеза ИФН как факторов противовирусного иммунитета и интенсификация фагоцитарных реакций.
Результаты применения Иммунала пациентами с аллергическими заболеваниями
Профилактическое использование Иммунала больными аллергическими заболеваниями позволило снизить заболеваемость ОРВИ в 1,4 раза.
При применении Иммунала уменьшилась длительность ОРВИ на 2 дня.
На фоне применения Иммунала уменьшилась выраженность симптомов интоксикации.
Иммуномодулирующий эффект Иммунала проявлялся в увеличении фагоцитарной активности нейтрофилов и цитокинов (табл. 3).
Применение Иммунала позволило снизить развитие бактериальных осложнений в 1,2 раза, а также использование антибактериальных препаратов.
В настоящее время общепризнанно, что ведущая роль в противовирусной защите организма принадлежит системе ИФН, способной подавлять множество РНК- и ДНК-содержащих вирусов вследствие ингибирования процессов транскрипции и трансляции вирусных матриц. ИФН оказывают действие на все клетки иммунной системы, формируют защитный барьер, стимулируют клеточную резистентность. На первых этапах иммунного ответа ИФН и ФНО активируют NК-клетки, стимулирующие продукцию ИФН-γ задолго до начала его синтеза Т-лимфоцитами.
ИФН и индукторы ИФН представлены широким классом лекарственных средств, активно используемых в профилактике и терапии респираторных инфекций. К ним относятся лейкоцитарный ИФН, выделенный из донорской крови человека, Виферон, Гриппферон, Арбидол, Амиксин, Циклоферон. Эффективными индукторами ИФН являются нуклеиновые кислоты и их различные производные. Среди препаратов с противовирусным действием выделяют также Анаферон и Афлубин [10].
Гриппферон (рекомбинантный ИФН-α2) выпускается в виде капель в нос и мази Интерген. Препарат применяют в первые дни заболевания гриппом и другими ОРЗ. Гриппферон вводят интраназально по 2 капли, а мазь Интерген наносят на слизистую оболочку носа 3–4 раза, а также на миндалины 2 раза в сутки с длительностью курсового лечения 5–7 дней. Использование обоих препаратов сопровождалось у большинства детей увеличением содержания секреторного IgA в носовых секретах и повышением уровня индуцированных ИФН-α и -γ в сыворотке крови. Отмечена более быстрая элиминация возбудителя из носовых ходов обследованных пациентов и достоверное снижение частоты возникновения внутрибольничных инфекций, однако была установлена меньшая эффективность препарата в случаях аденовирусной инфекции.

Арбидол (этилового эфира 6-бром-5-гидрокси-1-метил-4-диметиламинометил-2-фенилметиллинодол-3-карбоновой кислоты гидрохлорида) терапевтически эффективен в отношении болеющих гриппом и другими ОРВИ. Это позволяет использовать данный препарат в амбулаторных условиях без лабораторной верификации диагноза. Препарат применяется на ранних сроках заболевания, но не позже чем в первые 3 дня от начала болезни. Причем эффективность терапии во многом определяет возможность приема препарата в первые 6 часов заболевания. Арбидол назначают пациентам старше 6 лет по 50 мг (1 таблетка) 3 раза в сутки в течение 3–4 дней.
Изучение профилактической эффективности Амиксина (2,7-Бис [этиламоно]этоксифлуорена-9-дигидрохлорида) в отношении ОРВИ в период сезонного подъема заболеваемости показало ее снижение среди медицинских работников в 1,5 раза. Получены данные о благоприятном влиянии Амиксина на течение ОРВИ у лиц, страдающих аллергическими заболеваниями, в частности бронхиальной астмой.
Циклоферон (активное вещество – акридоноуксусная кислота в виде метилглюкаминовой соли) обладает противовирусным, иммуномодулирующим, противовоспалительным действиями. Выпускается в таблетках и растворе для парентерального применения. Используется в первые дни заболевания гриппом и ОРВИ.
Анаферон принадлежит к новому классу лекарственных препаратов, созданных на основе сверхмалых доз антител. Действующим веществом Анаферона являются антитела к ИФН-γ человека в сверхмалых дозах. Препарат используют с 6-месячного возраста для профилактики и лечения гриппа, а также других ОРВИ по 1 таблетке 1 раз в сутки в течение 30–90 дней. Результаты проведенных исследований показали профилактическую эффективность препарата в период эпидемического подъема заболеваемости ОРВИ, а также восстановление нарушенного микробиоценоза ротоглотки, благоприятное влияние на показатели гуморального и клеточного иммунитета.
Виферон – человеческий рекомбинантный ИФН-α-2b. Выпускается в дозах 150 тыс. МЕ, 500 тыс. МЕ, 1 млн МЕ в виде мази для наружного применения и суппозиториев для ректального использования. Препарат показан к профилактике и лечению ОРВИ. Доза подбирается по возрасту.
Афлубин – комплексный гомеопатический препарат, оказывающий противовоспалительное, иммуномодулирующее, жаропонижающее действия. Афлубин показал высокую эффективность при плановой профилактике по защите учащихся общеобразовательных школ от гриппа и ОРВИ. Показана его выраженная противовирусная активность в исследованиях in vitro. Антивирусная активность Афлубина была сопоставимой с таковой известных противовирусных препаратов и индукторов ИФН химического происхождения. Клинические исследования показали, что использование этих иммуномодуляторов эффективно также в остром периоде ОРВИ, но не позже чем в первые 24 часа заболевания (до момента попадания вируса в клетку). При этом уменьшается выраженность клинических проявлений и более быстрое обратное развитие заболевания.
Таким образом, проблема эффективного использования ИМТ остается крайне актуальной. Совместные усилия клинических иммунологов и педиатров должны быть направлены на снижение неоправданных назначений иммунотропных средств, т.к. последствия применения этих препаратов по тяжести осложнений и побочных эффектов могут превосходить таковую самого заболевания. Заслуживает внимания накопленный опыт использования бактериальных лизатов, восполняющих недостаток физиологической иммуностимуляции. Перспективно применение растительных адаптогенов, а также препаратов ИФН и его индукторов как в профилактической, так и в лечебной целях. Думается, у ИМТ большое будущее – в основном за счет повышения специфичности и точечной адресной направленности ее воздействия.


