Введение
В настоящий момент эрадикационная терапия (ЭТ) подразумевает стандартные терапевтические режимы, направленные на полную элиминацию инфекции Helicobacter pylori (H. pylori), является основным методом лечения и профилактики ряда H. pylori-ассоциированных заболеваний, что отражено в ряде международных консенсусов [1–3]. В современной клинической практике к важным аспектам ЭТ относятся ее переносимость и безопасность в силу риска развития потенциальных побочных явлений на компоненты, входящие в состав лекарственных препаратов. Развитие побочных явлений снижает приверженность пациента к терапии, что неизбежно приводит к снижению эффективности назначенного лечения [4, 5]. Актуальность этой проблемы определена не только тем, что все схемы ЭТ первой линии включают сразу два антибактериальных препарата в высоких дозах, но и длительностью самого курса лечения, который, согласно современным рекомендациям, должен составлять не менее 10 дней [3].
Действительно, при назначении стандартных схем ЭТ побочные явления развиваются в высоком проценте случаев и могут достигать 50% [6]. Недавно проведенный крупный мета-анализ B.Z. Li и соавт. (2015) продемонстрировал, что риск побочных явлений при применении ЭТ составляет 14–34% [7]. Помимо этого актуальной составляющей безопасности ЭТ считается ее потенциальная гепатотоксичность, ведь на настоящий момент антибактериальные препараты рассматриваются как довольно распространенная причина лекарственно-индуцированных поражений печени. Показана четкая корреляция последних с высокими дозами, полипрагмазией (в т.ч. и количеством антибиотиков в схеме терапии) и наличием сопутствующей патологии печени [8–10].
В связи с этим целью нашего исследования было изучение безопасности двух современных схем ЭТ (классическая тройная и последовательная терапии) для пациентов с сопутствующей патологией печени, представленной хроническим гепатитом С (ХГС).
Материалы и методы
На клинической базе кафедры пропедевтики внутренних болезней и гастроэнтерологии МГМСУ им. А.И. Евдокимова МЗ РФ было проведено проспективное клиническое исследование с рандомизацией в параллельных группах. Группу 1 (HCV-) составили 50 пациентов с H. pylori-ассоциированной язвенной болезни желудка (ЯБЖ) или двенадцатиперстной кишки (ДПК). В свою очередь 2-ю группу (HCV+) составили 50 пациентов с сочетанием H. pylori-ассоциированной ЯБЖ/ДПК и ХГС. Каждая из основных групп была разделена на две подгруппы в процессе рандомизации в зависимости от назначаемой схемы ЭТ: классическая тройная терапия (ингибитор протонной помпы в стандартной дозе+амоксициллин 1000 мг 2 раза в день+кларитромицин 500 мг 2 раза в день в течение 10 дней) или последовательная терапия (первые 5 дней: ингибитор протонной помпы в стандартной дозе+амоксициллин 1000 мг 2 раза в день; последующие 5 дней: ингибитор протонной помпы в стандартной дозе+кларитромицин 500 мг 2 раза в день+метронидазол 500 мг 2 раза в день).
Диагноз ЯБЖ или ДПК базировался на основании жалоб пациента на боли в эпигастрии и пилородуоденальной зоне, явлений диспепсии, анамнеза заболевания, данных объективного обследования больного, а также результатов эзофагогастродуоденоскопии. В исследование также включены пациенты с ЯБЖ или ДПК в стадии ремиссии, у которых на момент обследования была идентифицирована инфекция H. pylori, а ЭТ ранее не проводилась. Биохимический анализ крови выполнен для изучения уровней печеночно-специфических ферментов. Оценивались показатели цитолитического и холестатического синдрома с определением уровней сывороточных печеночных трансаминаз (аланинаминотрансфераза, аспартатаминотрансфераза), щелочной фосфотазы, γ-глутамилтранспептидазы, общего и прямого билирубина. Данный метод исследования проведен повторно после окончания ЭТ с целью оценки динамики вышеперечисленных показателей. Побочные явления назначенной ЭТ регистрировались в первичной документации, после чего переносились в индивидуальные регистрационные карты.
Статистическая обработка данных проведена с помощью специализированного программного обеспечения Statistica® 8.0 (StatSoft, США) и MedCalc® 15.8 (MedCalc Software, Бельгия). Полученные результаты оценены как статистически достоверные при значениях р<0,05.
Результаты
Согласно поставленным задачам исследования, в работу были включены 100 пациентов, страдавших ЯБЖ или ДПК и их сочетанием с ХГС. Средний возраст обследованных пациентов составил 47 (интерквартильный интервал 35; 56,5) лет. В гендерной структуре преобладали мужчины (n=77) по сравнению с женщинами (n=23).
Проведенный анализ безопасности назначавшихся схем ЭТ свидетельствует об удовлетворительной переносимости проводившейся терапии. Частота суммарно выявленных побочных явлений составила 20% в группе 1 (HCV-) и 28% в группе 2 (HCV+) (p=0,48). Все отмеченные у пациентов побочные явления не требовали отмены проводившейся терапии и купировались самостоятельно после ее окончания. Отношение шансов развития хотя бы одного побочного явления у HCV-инфицированных лиц по сравнению с группой HCV-негативных составило 1,4 (95% ДИ: 0,56–3,44, p=0,4643).
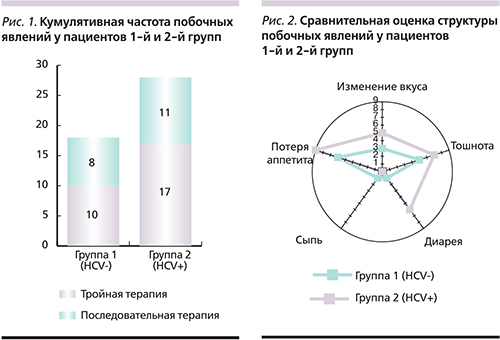
В связи с тем что у части пациентов отмечено несколько побочных явлений, нами была оценена кумулятивная частота в обеих группах. На рис. 1 представлена более частая кумулятивная частота побочных явлений в группе HCV-инфицированных пациентов (n=28 против n=18) вне зависимости от назначавшейся схемы ЭТ.
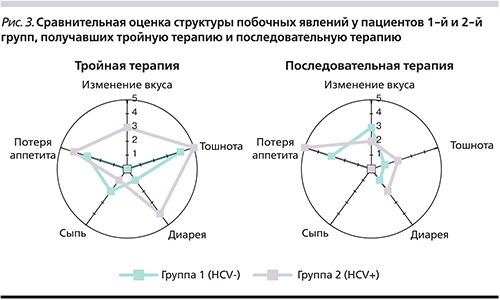
Анализ частоты развития побочных явлений в зависимости от схемы ЭТ продемонстрировал, что последовательная терапия сопровождалась более редким развитием побочных явлений (22%) по сравнению с классической тройной (26%) в обеих группах без статистической значимости (p=0,81). При сепаратном анализе частоты каждого из выявлявшихся побочных явлений доминировали такие проявления, как потеря аппетита, тошнота, изменение вкуса и диарея. Все описанные выше побочные явления чаще регистрировались в группе 2 (HCV+), за исключением кожной сыпи, которая была наиболее редким побочным явлением и зарегистрирована суммарно лишь у трех пациентов (рис. 2).
При сравнении двух схем ЭТ по частоте развития побочных явлений было отмечено, что последовательная терапия обладает более благоприятным профилем безопасности. Действительно, такие нежелательные явления, как изменение вкуса, тошнота, диарея и сыпь, при применении последовательной терапии регистрировались реже при сравнении с тройной схемой терапии. Эта тенденция отмечена в обеих группах (рис. 3).
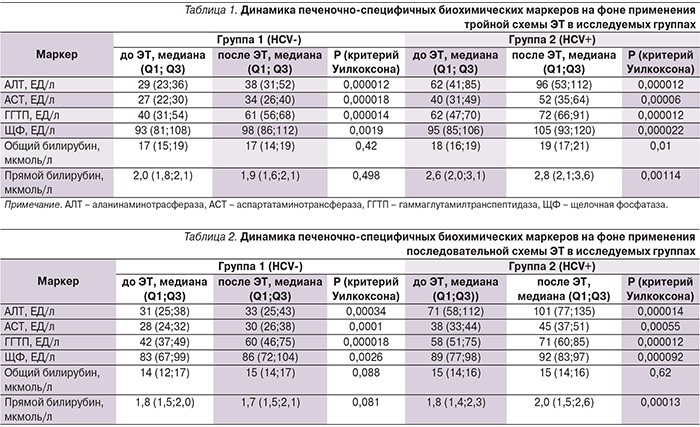
В рамках оценки безопасности исследуемых схем ЭТ нами анализировалась динамика печеночно-специфичных биохимических показателей в исследуемых группах. До проведения ЭТ у пациентов группы 2 (HCV+) статистически чаще выявлялось повышение печеночных трансаминаз, что представляется нам закономерным в связи с наличием у них хронического заболевания печени. При оценке динамики биохимических маркеров после проведения ЭТ нами была отмечена тенденция к увеличению оцениваемых печеночно-специфичных показателей в обеих группах, однако более выраженная у пациентов, получавших классическую тройную терапию по сравнению с последовательной схемой (табл. 1 и 2). Несмотря на данную негативную тенденцию, стоит отметить, что медианы анализируемых лабораторных показателей остались в пределах референсного интервала нормы у пациентов группы 1 (HCV-) вне зависимости от применявшейся схемы ЭТ.
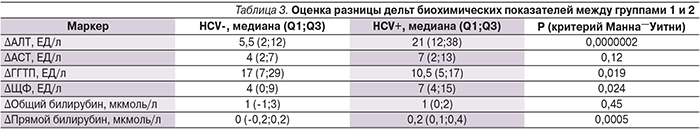
При оценке разницы дельт печеночно-специфичных биохимических маркеров до и после лечения нами было отмечено достоверно более выраженное изменение показателей АЛТ, ЩФ и прямого билирубина у пациентов группы 2 (HCV+) (табл. 3).
Таким образом, полученные данные позволяют констатировать, что ЭТ достоверно оказывает негативное влияние на динамику биохимических маркеров цитолитического и холестатического синдромов, в большей степени у пациентов с сопутствующим ХГС.
Заключение
Резюмируя результаты исследования, можно отметить, что частота развития побочных явлений при проведении ЭТ выше у пациентов с сопутствующим ХГС на 8% с отношением шансов 1,40 (95% ДИ: 0,56–3,44). У пациентов с ХГС отмечена более частая кумулятивная частота побочных явлений (n=28 против n=18) вне зависимости от назначавшейся схемы ЭТ. Несколько более высокая частота побочных явлений ЭТ у HCV-инфицированных пациентов объясняется сопутствующим хроническим поражением печени как фактором, увеличивающим риск нежелательных лекарственных явлений [11, 12]. В целом последовательная терапия характеризуется более благоприятным профилем безопасности. Что подтверждается рядом сравнительных исследований и последним сетевым мета-анализом [7, 13, 14].
Стоит отметить, что ЭТ достоверно оказывает негативное влияние на динамику биохимических маркеров цитолитического и холестатического синдромов, в большей степени среди пациентов с сопутствующим ХГС.
В группе 1 (HCV-) медианы анализируемых лабораторных показателей, несмотря на тенденцию к росту, остались в пределах референсного интервала нормы. Более выраженная негативная динамика печеночно-специфичных биохимических показателей в группе 2 обусловлена наличием сопутствующей патологии печени как риска гепатотоксичности [12, 15]. Тем не менее наличие выявленного гепатотоксического влияния препаратов ЭТ на часть пациентов не повлияло на продолжительность курса лечения и эффективность терапии. Однако для исключения более значимых лекарственных поражений печени рекомендовано проводить мониторинг биохимических показателей в процессе ЭТ.


