Желудок долгое время считался почти стерильным органом благодаря продукции соляной кислоты. Однако открытие в 1983 г. Helicobacter pylori показало, что существуют микроорганизмы, не только приспособленные к выживанию в кислой среде, но и колонизирующие именно этот отдел желудочно-кишечного тракта (ЖКТ).
H. pylori – это микроб, патогенная роль которого в развитии хронического гастрита доказана экспериментально и подтверждена тремя постулатами Коха. Несмотря на активное выявление и лечение, инфекция H. pylori остается наиболее распространенной на Земле, примерно 40% всего населения планеты инфицированы H. pylori. При этом распространенность хеликобактериоза в развитых странах существенно снизилась за прошедшие с момента его открытия 30 лет, но в некоторых развивающихся странах число инфицированных остается высоким. Риск инфицирования связан прежде всего с низким социально-экономическим статусом, скученностью проживания, пребыванием в закрытых коллективах, низким уровнем образования.
Обычно после инфицирования H. pylori становится абсолютно доминирующим микробом в желудке. Однако оказалось, что в желудке обитают и другие микроорганизмы.
Несмотря на то что рН в просвете желудка составляет 1,5–2 ЕД, покрывающий эпителий слой слизи создает градиент концентрации ионов водорода между полостью желудка и поверхностью эпителия. В пристеночных слоях слизистого слоя рН приближается к нейтральным значениям, что позволяет некоторым микробам помимо H. pylori обитать там. Гистологически в слое слизи обнаружены различные микробы [1]. У здоровых людей из желудка были изолированы и культивированы Propionibacteria, Lactobacillus, Streptococcus и Staphylococcus [2].
К сожалению, возможности бактериологического метода весьма ограничены и полная комплексная оценка микробиоты с его помощью недостижима, поскольку более 80% микроорганизмов пока не культивируемы. Появление современных молекулярно-генетических методов исследования, основанных на амплификации бактериальных 16S-rРНК генов, позволило получить более полную информацию о представителях микробного сообщества желудка. Оказалось, что микробиота желудка значительно более разнообразна, чем представлялось ранее: в нескольких современных исследованиях идентифицировано более 200 бактериальных филотипов. Несмотря на агрессивные условия среды, в желудке обнаружены представители 7–13 главных типов, свойственных и другим отделам ЖКТ, к основным из которых относятся 5: Firmicutes, Proteobacteria, Actinobacteria, Bacteroidetes, Fusobacteria [3].
E.M. Bik и соавт. [4] впервые исследовали 16S-rДНК последовательности в биоптатах слизистой оболочки желудка 23 взрослых пациентов, направленных на эндоскопию. Они установили, что среди представителей желудочного бактериального сообщества доминируют 5 основных типов микробов: Proteobacteria; Firmicutes; Bacteroidetes; Actinobacteria и Fusobacteria. Остальные желудочные 16S-rДНК-последовательности могут быть отнесены к Deferribacteres и Deinococcus. Тринадцать (10%) из обнаруженных в желудках бактериальных филотипов, включающих 24 клона, не были ранее описаны. Из 128 филотипов, выявленных в этом исследовании, 64 (50%) относились к ранее не культивируемым бактериям. Из них 43 (67%) были ранее обнаружены в ротовой полости людей, что подтверждает вероятность формирования микробиома желудка не как абсолютно изолированного сообщества, а как физиологически связанного с соседними органами и пополняемого при попадании содержимого в основном из вышележащих отделов ЖКТ. Среди не культивируемых ранее микробов в желудке выявлены Caulobacter, Actinobacillus, Corynebacterium, Rothia, Gemella, Leptotrichia, Porphyromonas, Capnocytophaga, TM7, Flexistipes, Deinococcus.
H. pylori в данном исследовании был единственным из рода Helicobacter и представлял собой наиболее многочисленный вид. H. pylori был обнаружен у 19 из 23 пациентов и составил 42% всей совокупности последовательностей. Только у 12 из 19 больных, у которых присутствовал H. pylori, он был диагностирован с помощью общепринятых методов. У всех 12 пациентов H. pylori доминировал среди других микробов, составив в среднем 72% всех обнаруженных клонов, в то время как у 7 пациентов, у которых H. pylori был выявлен не обычными методами, а только секвенированием, он не был доминирующим микробом и составил 11% всех бактериальных клонов. Вероятно, незначительная степень обсемененности H. pylori и стала причиной ложно(-) результатов традиционных методов диагностики H. pylori. У 4 больных, у которых H. pylori не обнаружен при секвенировании по 16S-рДНК, он также не был выявлен традиционными методами, т.е. эти пациенты были H. pylori(-). Следующими по частоте после Helicobacter родами бактерий в желудочном микробиоме были Streptococcus (299 клонов) и Prevotella (139 клонов).
Максимальное богатство видов бактерий в желудочном микробиоме было обнаружено у H. pylori-пациентов (138,8±66,3), у них же был выше индекс разнообразия микробов (индекс Shannon) – 3,1. У H. pylori-инфицированных больных отмечено уменьшение видового богатства (81,2±15,1) и индекса разнообразия микробов [1, 6]. У H. pylori (+) больных наблюдалось значительное уменьшение всех микробных типов, кроме Proteobacteria, особенно снижались Bacteroidetes. Сравнение состава микробиоты антрального отдела и тела желудка не выявило достоверных отличий. В целом микробиота желудка характеризовалась значительной индивидуальной вариабельностью, свойственной и другим отделам ЖКТ.
Взаимодействие H.pylori с другой микробиотой желудка
Исследования на животных показали, что длительная колонизация желудка H. pylori влияет на состав желудочного микробиома в целом. У H. pylori(-) особей, в отличие от H. pylori(+) в желудке обитает масса Eubacterium cylindroides и различных видов Prevotella, но отмечено относительно небольшое количество видов Bifidobacterium, Clostridium leptum и Closridium coccoides [5]. У неинфицированных H. pylori людей количество Proteobacteria было небольшим, но присутствовало значительно больше видов Prevotella и Streptococcus, чем у инфицированных [6]. У H. pylori(+) пациентов было значительно большим представительство классов Proteobacteria, Spirochetes, Actinobacteria, а также Bacteroidetes и Firmicutes.
Эти микробиологические изменения могут объясняться несколькими причинами. Длительная H. pylori-инфекция приводит к развитию атрофии слизистой оболочки желудка, что сопровождается снижением секреторной функции и повышением рН. Это способствует колонизации желудка различными микробами. В дополнение аммиак и бикарбонаты, образующиеся в результате гидролиза мочевины уреазой H. pylori, могут быть использованы как субстраты другими микроорганизмами. Наконец, колонизация H. pylori может нарушать моторику желудка, что влияет на клиренс адгезированных к эпителию желудка бактерий. При выраженной атрофии и повышении рН локальные условия обитания H. pylori настолько меняются, что могут уже не соответствовать его потребностям, степень обсемененности им слизистой оболочки желудка может снижаться, что создает благоприятные условия для менее устойчивых к кислоте и не конкурентоспособных видов бактерий. То есть H. pylori создает условия и определенные ниши, которые в процессе прогрессирования атрофии заполняются другими микробами. Однако на ранних этапах развития H. pylori-инфекции окружающая его микробиота не претерпевает значительных изменений. В недавнем исследовании Y. Khosravi и соавт. [7] подтвердили это, сравнив большие группы H. pylori(+) (131 человек) и H. pylori(-) (84 человека) пациентов. Вероятно, не само присутствие H. pylori, а инициированные им изменения, такие как активность воспаления, наличие атрофии и кишечной метаплазии, их протяженность и локализация, а также длительность инфекции, являются определяющими для изменения состава желудочного микробиома в целом.
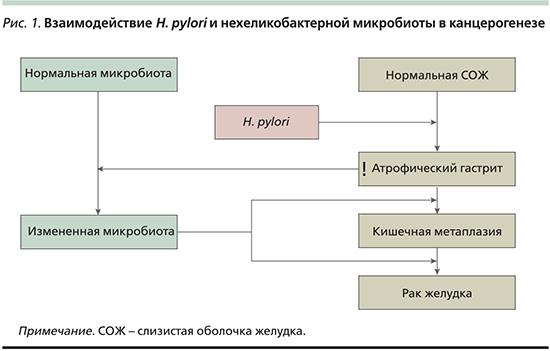
Микробиота желудка при его патологии. Роль микробиоты в канцерогенезе
Повышение внутрижелудочного рН драматическим образом усиливает бактериальный рост. Антисекреторная терапия, особенно длительные курсы ингибиторов протонной помпы (ИПП), сопровождается повышением количества микробов, отмена терапии приводит к постепенной нормализации [8].
Повышение рН и усиленная микробная колонизация коррелируют с увеличением продукции нитритов в желудке [9] благодаря нарастанию числа нитрат-редуцирующих бактерий, которые катализируют образование нитритов. Haemophilus и Veilonella редуцируют нитраты быстрее, чем нитриты, именно поэтому они могут быть ответственными за накопление нитритов в желудке. Как уже указывалось выше, количество этих видов микробов нарастает при раке и предраковых изменениях в желудке. N-нитрозосоединения, состоящие из N-нитрозаминов и N-нитрозамидов, являются потенциальными канцерогенами. Источником их могут быть продукты питания (красное мясо, колбасы), курение и другие факторы окружающей среды. Уровень эндогенной продукции N-нитрозосоединений, однако, значительно превышает их поступление извне. Исследование, проведенное на популяции, превысившей полмиллиона человек, показало, что эндогенные N-нитрозосоединения в значительной степени ассоциированы с развитием рака желудка [10]. Предшественником N-нитрозосоединений являются нитриты. Бактериальная цитохром-cd1-нитрит-редуктаза катализирует превращение нитритов в нитрозамины в присутствии вторичных аминов [11]. У больных раком желудка концентрация нитритов в желудочном соке может увеличиваться до 107,6 ммоль/л [12]. При снижении кислотной продукции колонизирующие желудок бактерии содержат как нитрит-, так и нитрат-редуктазу, катализирующие соответственно нитриты или нитраты. Однако их катализирующая активность может существенно различаться. Veilonella parvula и Haemophilus parainfluenzae отличаются значительным превалированием редукции нитратов над нитритами, что в итоге приводит к накоплению нитритов в желудке [13].
В природе многие микроорганизмы продуцируют ферменты, влияющие на продукцию нитритов. Они могут присутствовать и в организме человека, и в окружающей среде, с которой человек постоянно соприкасается: в почве, воде, в т.ч. морской. Окисляющие аммоний бактерии, обладающие аммоний-монооксидазой и гидроксиламин-оксидоредуктазой, катализируют образование нитритов из аммония в присутствии кислорода [14]. Эти бактерии относятся в основном к представителям класса Planctomycetes [15]. Логично было бы предположить, что не только H. pylori, но и другая микробиота желудка может играть определенную роль в канцерогенезе. Исследования на животных и людях показали, что колонизация желудка бактериями, естественной средой обитания которых являются нижние отделы ЖКТ, усугубляет последствия H. pylori-инфекции и риск развития рака желудка [16].
Мыши одной и той же генетической модели C57BL/6N, но выращенные в разных лабораториях в различных условиях, а затем инфицированные одним и тем же штаммом H. pylori, в итоге имели разную степень выраженности воспаления, атрофии и кишечной метаплазии слизистой оболочки желудка. Исследование нехеликобактерной микробиоты желудка этих двух групп показало существенные ее отличия, особенно в количестве лактобацилл [17], что подтверждает адъювантную роль резидентной микробиоты в развитии H. pylori-ассоциированной патологии желудка.
В другом исследовании безмикробные трансгенные INS-GAS мыши, предрасположенные к развитию рака желудка вследствие гиперпродукции гастрина, были разделены на две группы: одна, инфицированная H. pylori, оставалась в стерильных условиях, другая – в сочетании с колонизацией обычной кишечной микробиотой. Интраэпителиальная неоплазия развивалась значительно быстрее у мышей второй группы [18]. Колонизация желудка искусственной кишечной микробиотой, включившей виды Clostridium, Lactobacillus murinus и Bacteroidetes, повысила частоту развития неоплазий желудка у генетически предрасположенных мышей, и через 7 месяцев после заражения H. pylori неоплазия развилась практически у всех особей. У стерильных мышей после инфицирования H. pylori опухоли развивались медленнее и в меньшем проценте случаев: через 7 месяцев – у 10%, через 11 – у 44% [19]. Антибиотикотерапия после заражения H. pylori значительно задерживала развитие опухоли.
Перекрестное исследование, включившее 720 здоровых взрослых добровольцев в Китае, подтвердило предположение, будто снижение микробного разнообразия может предрасполагать к развитию рака желудка. Этот вывод был сделан на основании оценки взаимосвязи микробного многообразия и соотношения пепсиноген I/пепсиноген II. Чем ниже было многообразие, тем ниже соотношение пепсиногенов, что коррелирует с вероятностью атрофии слизистой оболочки тела желудка, предрасполагающей к развитию рака желудка [20].
Первое, основанное на секвенировании бактериальной 16S-rРНК исследование микробиоты желудка больных раком желудка, было проведено J. Dicksved и соавт. [21]. Было изолировано 102 филотипа, которые представляли 5 бактериальных типов: Firmicutes (60%), Bacteroidetes (11%), Actinobacteria (7%), Proteobacteria (6%) и Fusobacteria (3%). У больных раком обнаружено большее количество анаэробных бактерий (Clostridium, Bacteroidetes), чем в группе здоровых. Больные раком желудка отличались также более выраженным ростом Streptococcus, Lactobacillus, Veilonella, Prevotella на фоне снижения количества H. pylori.
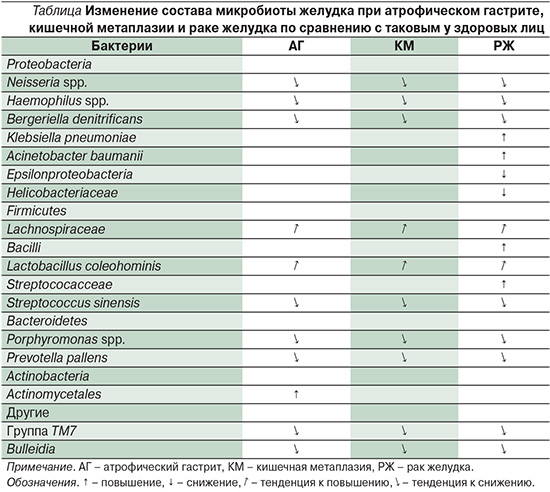
Недавно был прослежен постепенный сдвиг в профиле микробиоты желудка от неатрофического гастрита к кишечной метаплазии и затем к кишечному типу рака желудка [22]. Было обнаружено различие в количестве, составе и разнообразии микробиоты желудка между этими тремя группами, особенно при наличии H. pylori. Исследование с использованием техники, основанной на анализе 454 GS FLX-титания для микробного анализа с оценкой состава, разнообразия и количества микробов в желудке больных хроническим гастритом, кишечной метаплазией и раком желудка, показало значительное повышение числа бацилл в последней группе. У больных раком желудка был значительно снижен класс Epsilonproteobacteria и семейство Helicobacteriaceae, а уровень Streptococcaceae, напротив, повышен. Плотность колонизации и разнообразие микробиоты у больных раком желудка возрастали. По мере прогрессирования от неатрофического гастрита через атрофию и кишечную метаплазию к раку отмечено снижение содержания штаммов Porphiromonas, Neisseria, Bulleidia, Prevotella pallens, Str.sinensis и Bergeriella denitrificans, но повышение Lactobacillus coleohominis и Lachnospiraceae.
Обобщая данные исследований различных вариантов хронического гастрита и рака желудка, можно сделать следующее заключение: по мере развития предраковых изменений слизистой оболочки прогрессивно меняется и микробиота желудка в целом. Эти данные объединены в таблице.
Эти данные, полученные как в эксперименте на животных, так и в клинических исследованиях с участием людей, свидетельствуют о том, что нехеликобактерная микробиота желудка может менять иммунобиологический ответ слизистой оболочки и в результате влиять на последствия инфекции H. pylori, ускоряя процесс канцерогенеза. H. pylori инициирует изменения слизистой оболочки (воспаление, атрофия) и играет ведущую роль на ранних стадиях канцерогенеза. В последующие периоды на фоне снижения секреторной функции желудка и усиления колонизации слизистой оболочки желудка разнообразными бактериями, в особенности кишечными, они могут выходить на первый план в качестве ведущих факторов канцерогенеза (рис. 1).
Определенный микробиологический профиль, свойственный именно раку желудка, пока не установлен. Однако в недавнем исследовании I. Yang и соавт. [23] проведено сравнение микробиоты желудка двух генетически различных популяций жителей Колумбии: Tuquerres и Tumaco, у первых из которых частота рака желудка в 25 раз выше, чем у вторых, несмотря на одинаковую распространенность инфекции H. pylori. Оказалось, что состав нехеликобактерной микробиоты желудка у них различался: у Tuquerres было обнаружено повышение Leptospira wadei и Veilonella spр., у Tumaco преобладали Staphylococcus spр. Выше уже обсуждалась роль нитрозирующих бактерий, в частности Veilonella в канцерогенезе, что, возможно, объясняет разную частоту рака желудка в отдельных популяциях. Возможно, существуют и другие не менее важные дополнительные факторы. Однако делать окончательные выводы пока преждевременно. Одно можно сказать с уверенностью уже сегодня: H. pylori и нехеликобактерная микробиота желудка в совокупности играют роль в процессе канцерогенеза. По мере прогрессирования морфологических изменений в желудке меняется и микробиологический состав его обитателей, что может ускорить реализацию предраковых изменений и канцерогенез.
Возможно, в дальнейшем, когда будут установлены конкретные микроорганизмы, ответственные за реализацию канцерогенеза, появятся и новые биомаркеры, которые позволят выявлять их и прогнозировать повышенный канцерогенный риск, а также будут разработаны определенные пробиотики с антагонистической активностью, которые этот риск нивелируют.
Пробиотики в лечении инфекции H. pylori
Стандартная терапия инфекции H. pylori предполагает назначение схем эрадикации, включающих антибактериальные препараты и ИПП. Несмотря на применение двух антибиотиков одновременно в высоких дозах, результаты эрадикационной терапии оставляют желать лучшего. Это обусловлено прежде всего растущей антибиотикорезистентностью H. pylori, особенно к кларитромицину и метронидазолу. Учитывая новые данные о значении не только H. pylori, но и нехеликобактерной микробиоты желудка для прогрессирования патологического процесса, поиск альтернативных методов лечения становится еще более актуальным. Принимая во внимание возможность безопасного и комплексного воздействия на состав микробиоты желудка, слизистый барьер, а также иммуномодулирующее действие, пробиотики могут быть перспективным и многообещающим направлением терапии.

Важнейшим условием эффективной работы пробиотика в агрессивной среде желудка является его кислотоустойчивость и способность конкурентного воздействия на H. pylori. Кислотоустойчивостью обладают многие штаммы, она доказана для Saccharomyces boulardii, Lactobacillus rhamnosus GG, Lactobacillus reuteri, Lactobacillus plantarum, Lactobacillus acidophilus, Lactobacillus gasseri и др. Пробиотики могут оказывать прямое антагонистическое действие в отношении H. pylori, они конкурируют с ним за питательные вещества и сайты адгезии, вырабатывают метаболиты, подавляющие его рост. Многие штаммы вырабатывают бактериоцины – антибактериальные белки, которые ингибируют рост других микробов.
Короткоцепочечные жирные кислоты (КЦЖК), такие как уксусная, пропионовая, масляная и молочная, продуцируемые в ходе бактериального расщепления углеводов, подавляют рост H. pylori. Количество молочной кислоты, выделяемое Lactobacillus, Bifidobacterium и Pediococcus (50–156 ммоль), коррелировало с интенсивностью ингибирующего эффекта на H. pylori [24]. Это объясняется не только влиянием непосредственно на микроб, но и на его уреазную активность. Возможно, молочная кислота приводит к устранению эффекта локального защелачивания, способствующего выживанию H. pylori в желудке. Закисление окружающей H. pylori-среды препятствует нормальному росту и выживанию микроба. Поэтому микробы, продуцирующие молочную кислоту в большом количестве (Lactobacillus salivarius и Lactobacillus casei Shirota), подавляют H. pylori и снижают активность воспаления в желудке, что было продемонстрировано в эксперименте на мышах [25].
Антихеликобактерное действие оказывают и бактериоцины – мелкие термостабильные белки, которые синтезируются некоторыми бактериями, в частности лактобациллами. T.S. Kim и соавт. [26] оценили антихеликобактерную активность семи бактериоцинов, продуцируемых молочнокислыми бактериями (низин А, педиоцин РО2, леукоцин К и разные типы лактицинов). Лактицины А164 и ВН5, продуцируемые Lactobacillus lactis, отличались наибольшей ингибирующей активностью в отношении некоторых штаммов H. pylori, т.е. была показана штаммовая специфичность бактериоцинов. Лизаты L. acidophilus CRL639 за счет содержащихся в них бактериоцинов полностью убивали H. pylori после 48-часовой экспозиции [27].
Супернатант культуры пробиотического штамма L. johnsonii La1 ингибирует и уреазную активность, и рост H. pylori [28]. Эта активность обусловлена продуцируемым L. johnsonii бактериоцином лактацином F и проявляется, даже когда H. pylori адгезирован к культуре эпителиальных клеток, не зависит от токсигенности H. pylori и наличия островка патогенности. Назначение супернатанта L. johnsonii La1 взрослым H. pylori(+) пациентам значительно снижало показатели С13-дыхательного теста.
Похожие результаты были получены M.H. Coconnier и соавт. [29], которые инкубировали H. pylori с супернатантом L. acidophilus LB: выживаемость H. pylori, его уреазная активность и адгезия к эпителию снижались в соответствии с дозой LD. Этот эффект не зависел от молочной кислоты и рН, не снижался после кипячения. Бактерии H. pylori выглядели морфологически дефектными после инкубации с супернатантом LB, меняя спиралевидную форму на U-образную и уменьшая размеры, что соответствует прекокковидной модификации H. pylori. Но антихеликобактерное действие пробиотических бактерий штаммоспецифично. Так, супернатант L. rhamnosus GG не оказывал никакого воздействия на H. pylori [29].
Как уже указывалось выше, пробиотики L. acidophilus LB и L. johnsonii La1 уменьшают также активность воспаления в желудке. Это было отмечено и в отношении других видов бактерий: L. salivarius WB1004, L. rhamnosus R0011, L. acidophilus R0052 и L. gasseri 0ll2716. Прием йогурта, содержащего L. gasseri, защищал экспериментальных животных от развития острого химического гастрита в отличие от молока [30]. Прием йогурта сопровождался увеличением содержания простагландина E2 (ПГE2) в слизистой оболочке желудка. Протективное действие за счет повышения уровня простагландина и ростовых факторов (EGF и bEGF) было продемонстрировано также у пробио-тических штаммов бифидобактерий: Bifidobacterium breve и Bifidobacterium bifidum, их прием препятствовал ульцерации слизистой оболочки желудка у крыс [31]. Даже применение полисахаридов бифидобактерий имело аналогичное антиульцерозное действие, этот эффект зависел от количества полисахаридов, содержащих рамнозу.
Попытки улучшить результативность эрадикации с помощью пробиотиков были предприняты в ряде работ. Большинство исследований посвящено оценке терапии пробиотиками на фоне стандартных схем. Так, в рандомизированном плацебо-контролируемом исследовании M. Cindoruk и соавт. [32] 124 пациента с H. pylori-ассоциированными гастродуоденальными заболеваниями были разделены на 2 группы, одна из которых получала обычную эрадикационную терапию (ИПП+амоксициллин+кларитро-мицин в стандартных дозах), другая на ее фоне – S. boulardii 1000 мг/сут. Применение S. boulardii на фоне стандартной тройной схемы улучшило ее переносимость, уменьшив выраженность диареи, метеоризма и болей. Увеличилась и результативность лечения – эрадикация была достигнута в 71 против 59% в контрольной группе. В многоцентровом исследовании, проведенном в Турции и включившем 389 пациентов [33], показано, что применение S. boulardii на фоне тройной терапии снижает вероятность антибиотико-ассоциированной диареи (5,9% в основной группе против 11, 5% в контрольной).
В исследовании E. Lionetti и соавт. [34] оценили эффективность применения L. reuteri у детей на фоне последовательной терапии (5 дней омепразол+амоксициллин, затем 5 дней – омепразол+кларитромицин+тинидазол). Авторы отметили уменьшение симптомов диспепсии на фоне пробиотика (4,1 против 6,2 балла).
Наше исследование с участием 24 детей с хроническим гастритом и язвенной болезнью на фоне стандартной эрадикационной терапии (10 дней эзомепразол+амоксициллин+метронидазол+трикалия дицитрат висмута), дополненной приемом B. longum 107 и Str. .faecium 107 2 раза в сутки в течение 14 дней, продемонстрировало снижение уровня провоспалительных цитокинов (фактор некроза опухоли α, интерлейкин-1b – ИЛ-1b) и повышение уровня секреторного иммуноглобулина А (IgA) в слизистой оболочке желудка, повышение фагоцитарной активности, снижение IgE в крови и повышение процента эрадикации H. pylori с 72 до 82% [35].
B.S. Sheu и соавт. [36] рандомизировали 138 пациентов, половина из которых в течение 4 недель перед стандартной квадротерапией получали 400 мл йогурта, содержащего лакто- и бифидобактерии. В группе, получавшей йогурт, наблюдался более высокий процент эрадикации H. pylori (85 против 71% в группе сравнения).
В ряде работ оценивалась эффективность продуктов функционального питания, в частности йогуртов, содержащих различные штаммы лактобацилл. J. Sykora и соавт. [37] изучали эффективность кисломолочного продукта, содержащего L. casei DN-114001, у детей в дополнение к стандартной тройной терапии. Было показано достоверное повышение уровня эрадикации H. pylori. Уменьшение плотности колонизации слизистой оболочки желудка было продемонстрировано при применении продуктов, содержащих L. gasseri LG21, L. acidophilus, L. brevis, B. lactis. N. Uemura и соавт. доказали профилактическое действие некоторых штаммов лактобацилл, в частности L. gasseri LG21, в сдерживании развития атрофического гастрита при персистировании H. pylori [38]. Прием LG21 сопровождался снижением уровня ИЛ-8 в слизистой оболочке желудка, а также тенденцией к нормализации соотношения пепсиногенов ПГ1/ПГ2 в сыворотке крови. Мета-анализ 10 рандомизированных исследований, включивших 963 пациента, получавших продукты функционального питания с пробиотиками на фоне стандартной терапии H. pylori, и 465 пациентов группы сравнения, показал, что пробиотики повышают уровень эрадикации H. pylori на 5–15% и снижают выраженность побочных эффектов основной терапии [39].
Несколько исследований было посвящено оценке эффективности монотерапии H. pylori-инфекции пробиотиками. M. Gotteland и соавт. [40] сравнили эффективность монотерапии S. boulardii, монотерапии L. acidophilus LB и стандартной 7-дневной тройной терапии для H. pylori-инфицированных школьников. Пробиотики применяли дважды в сутки на протяжении 2 месяцев. Эрадикация H. pylori была достигнута 66% детей, получавших тройную схему, 12% – получавших монотерапию S. boulardii и 6,5% – получавших монотерапию L. acidophilus LB.
В работе В.И. Симаненкова и соавт. [41] с использованием E. faecium L-3 в качестве монотерапии больных хроническим гастритом и язвенной болезнью было продемонстрировано не только улучшение клинической симптоматики, но и достижение эрадикации H. pylori соответственно в 45 и 30%.
Прием кисломолочного продукта, содержащего L. johnsoni La1 (LC1), 50 бессимптомными добровольцами с хроническим гастритом в течение 16 недель сопровождался достоверным снижением активности воспаления в слизистой оболочке желудка и плотности колонизации H. pylori. Отмечено также утолщение слизистого слоя на фоне приема LC1 [42].
Проведенное нами исследование эффективности монотерапии убитыми L. reuteri DSMZ17648 (200 мг/сут в течение 30 дней) для 43 детей с хроническим H. pylori-ассоциированным гастритом по сравнению со стандартной 10-дневной терапией (омепразол+амоксициллин+метронидазол+трикалия дицитрат висмута) показало недостоверное различие (p>0,05) эффективности: эрадикация достигнута 62% больных, получавших стандартную схему и 50% после монотерапии пробиотиком (рис. 2). При этом монотерапия L. reuteri не сопровождалась никакими побочными эффектами и в итоге привела к более значимому уменьшению активности воспаления в слизистой оболочке желудка: воспалительный индекс (ВИ) достоверно снизился через месяц после окончания лечения у пациентов, получавших L. reuteri, как на фоне стандартной схемы, так и в виде монотерапии (рис. 3).
Таким образом, многие пробиотики оказывают достаточно эффективное антихеликобактерное действие in vitro и in vivo. Они уменьшают активность воспаления в слизистой оболочке желудка, увеличивают толщину слизистого слоя, обладают иммуномодулирующим действием и в отличие от антибиотиков не сопровождаются никакими побочными эффектами. Показатели эрадикации H. pylori после монотерапии пробиотиками пока недостаточно высокие, но эффект штаммоспецифичен. Поэтому, если взвешивать пользу и риск терапии, то, учитывая безопасность пробиотической терапии и ее вероятное положительное влияние на весь микробиом желудка в совокупности, она выглядит гораздо более привлекательной. Дальнейшие исследования могут быть направлены на поиск более эффективных штаммов и микробных метаболитов, оценку более длительного и регулярного приема пробиотических продуктов, что в конечном итоге может принципиально поменять концепцию антихеликобактерной терапии и снизить риск развития более тяжелых форм H. pylori-ассоциированной патологии.


