Формирование современного понимания роли антипсихотической терапии и тактики ее проведения
Первый препарат антипсихотического дей ствия (хлорпромазин) был разработан в 1950 г. в лаборатории Rhone-Poulenc; в 1952 г. права на препарат были проданы компании Smith-Kline & French. Создание хлорпромазина было прорывом в мировой психиатрии и фактически положило начало эре психофармакологии. Фармакологи по значимости сравнивают его появление в медицине с открытием пенициллина. Несмотря на последующую разработку многочисленных новых препаратов, он продолжает широко применяться в медицинской практике.
Успех хлорпромазина привел к появлению массы препаратов сходной фенотиазиновой структуры. Ни один из них не превосходил хлорпромазин в отношении основного дей ствия, однако все эти препараты отличались дополнительными и побочными эффектами.
Существенный вклад в разработку антипсихотических препаратов (АПП) внес бельгийский фармаколог
П. Янссен. В феврале 1958 г. он синтезировал эталонный ней ролептик галоперидол, за которым в течение ряда лет последовало более 10 других препаратов антипсихотического дей ствия. В их числе: флушпирилен, пимозид, Галоперидол деканоат (депонированная форма) и рисперидон. В отличие
от хлорпромазина открытие галоперидола не было случай ным: по словам Янссена, идея родилась после того, как он наблюдал интоксикационные психозы у спортсменов, принимавших амфетамин в качестве допинга. Результатом этого был целенаправленный поиск соединений с противоположными амфетамину свойствами, что, по его мнению, должно былопомочь пациентам с бредом и галлюцинациями [30].
Первоначально ней ролептики использовались в очень высоких дозах (до 3000 мг/сут хлорпромазина), что приводило к чрезвычайно выраженным побочным эффектам. Среди наиболее характерных отмечены экстрапирамидные нарушения в виде как эффектов, отмечаемых с начала терапии, так и т. н. поздней дискинезии (появляющей ся отроченно после длительного курса ней ролептической терапии).
Термин “ней ролептики” (ней ролептические средства) был предложен еще в 1967 г., когда разрабатывалась первая классификация психотропных препаратов. Им обозначали средства, предназначенные в лечении тяжелых заболеваний центральной нервной системы (психозов) и вызывающие характерные побочные (ней ролептические) эффекты. В последнее время вместо этого термина предложено использовать более предпочтительный – “антипсихотические препараты”, поскольку “ней ролептический синдром” является не основным, а нежелательным эффектом, осложняющим основное терапевтическое дей ствие и свой ственным лишь первым представителям этой группы лекарственных средств.
Первое определение эффективной дозы было дано Х. Хаасе и П. Янссеном, предложившими использовать в качестве критерия начала ней ролепсии появление неврологических симптомов, таких как изменение почерка пациента. Этим было установлено понятие “минимальная эффективная
доза”, которая оказывает достаточное терапевтическое воздей ствие и минимизирует риск развития нежелательных побочных эффектов [14].
Антипсихотические препараты устраняют многие проявления шизофрении, в первую очередь позитивную симптоматику (бред, галлюцинации). Антипсихотические препараты второго поколения, называемые атипичными, в дополнение к основному дей ствию также способны влиять на некоторые негативные симптомы: социальную апатию, эмоциональное оскуднение, аутизм. Терапевтическое
дей ствие АПП состоит из ряда эффектов (рис. 1), каждый из которых проявляется на определенном этапе лечения: с момента начала (непосредственные эффекты) или на более поздних этапах (отсроченные эффекты).
Рисунок 1. Терапевтическое действие антипсихотических препаратов (Авруцкий,1988; Мосолов, 1996 с изменениями).
Механизм действия антипсихотических средств
Большинство известных сегодня препаратов реализует свое действие через общий механизм – антагонизм дофаминовых рецепторов, блокируя передачу нервных импульсов (нейротрансмиссию) в
тех нейрональных системах мозга, где передатчиком нервных импульсов является дофамин. Собственно, антипсихотическое действие связывается со снижением передачи нервных импульсов в дофаминовых системах мезолимбической и мезокортикальной областей мозга. Поскольку дофаминергические нейроны встречаются в разных отделах головного мозга, наряду с основным терапевтическим действием АПП обладают и рядом побочных эффектов, связанных с блокадой
дофаминергической передачи в тех областях, которые отвечают за неврологические и нейроэндокринные эффекты. Так, блокада дофаминовых рецепторов в экстрапирамидной системе ведет к развитию нежелательных эффектов в виде экстрапирамидных расстройств (паркинсонизм, акатизия, повышение мышечного тонуса, слюнотечение, острая и поздняя дискинезии), наблюдаемых более чем в 60 % случаев при лечении типичными АПП. Аналогичное действие на тубероинфундибулярные дофаминергические проводящие пути в системе “гипоталамус–гипофиз” приводит к повышению уровня пролактина в крови, что вызывает такие нарушения, как гинекомастия, галакторея, нарушения менструального цикла и половые дисфункции.
Помимо действия на дофаминовые рецепторы большинство АПП блокируют рецепторы других нейромедиаторных систем: серотониновой, гистаминовой, адреналиновой, ацетилхолиновой и
ряда других. С некоторыми из этих свойств связан ряд общих побочных эффектов, развивающихся при их использовании.
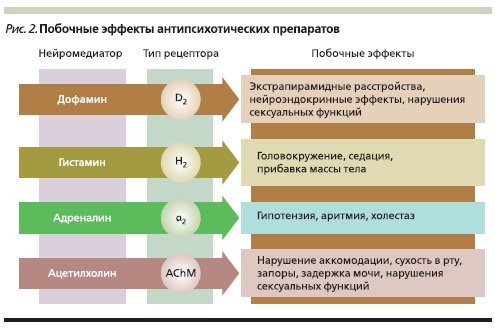
Поскольку способность воздействовать на те или иные рецепторы выражена у АПП в разной степени, каждому из них свойствен свой профиль основного терапевтического действия и побочных эффектов (рис. 2, см. таблицу).
Таблица. Основные препараты антипсихотического действия и их характеристики.
Понятие порога действия
Для АПП характерен феномен т. н. антипсихотического порога, ниже которого антипсихотическое действие не реализуется и проявляются лишь неспецифические эффекты – снотворный,
седативный и противотревожный или, напротив, активирующий и растормаживающий. Для развития
антипсихотического действия необходимо достижение уровня блокады дофаминергической активности не менее чем на 60 % (это касается в первую очередь рецепторов D2-типа). При этом гиперпролактинемия возникает при блокаде 75 % и более рецепторов; экстрапирамидные
расстройства – при блокаде 80 % и более. Таким образом, диапазон блокады активности (блокада 60–80 % дофаминовых рецепторов) составляет т. н. терапевтическое окно, в которое при их назначении следует “уложиться” для достижения необходимого действия, с одной стороны, и предотвращения побочных эффектов, с другой. Это положение является наиболее актуальным в отношении АПП первого поколения.
Атипичные антипсихотические препараты
Уже первое десятилетие использования нейролептических препаратов показало, что их применение сталкивается с определенными ограничениями. Среди них стоит отметить ряд нежелательных соматотропных эффектов, гормональные нарушения и др. Но главным и определяющим с самого начала их использования являлись экстрапирамидные нарушения, включившие ранние проявления (акатизию и тремор) и симптомы поздних дис-кинезий (гиперкинезы). Создание препаратов, лишенных этих недостатков, считалось насущной необходимостью, т. к. позволяло бы использовать их в большем диапазоне дозировок, при этом избежав назначения корректирующей терапии.
Поиск в этом направлении привел фармакологов к синтезу соединений, обладавших свойствами –
иными, чем у традиционных производных фенотиазина. На одном из этапов этого поиска был получен
не обладавший антипсихотическим действием имипрамин – первый трициклический антидепрессант.
На основании дальнейшей модификации основного дибензозепинового ядра практически одновременно в конце 1950-х гг. было получено три соединения сходной структуры: локсапин, амоксапин и клозапин. Первый из них оказался нейролептиком с переходными свойствами (ближе к типичным), второй – антидепрессантом комбинированного действия, третий – первым представителем группы атипичных АПП. Особенность клозапина, отличающая его от всех других известных к тому времени нейролептиков, – отсутствие каталептического эффекта. И хотя именно такого рода действие наряду с экстрапирамидной симптоматикой считалось в то время обязательной характеристикой АПП, исследования клозапина в этом направлении были продолжены. Тем не менее появление клозапина в широкой клинической практике было задержано почти на 30 лет из-за сообщений о возможности развития агранулоцитоза [13]. Только к концу 1990 г. эти данные прошли всестороннюю проверку, а повторно зарегистрированный препарат с рядом существенных ограничений нашел применение в арсенале психофармакологов.
Как уже упоминалось, исследования действия типичных АПП (первого поколения) показали существование связи между клиническим эффектом, экстрапирамидными побочными эффектами и количеством связанных (оккупированных) дофаминовых рецепторов. Однако клозапин обладал свойством оказывать достаточный терапевтический эффект при соотношении связанных рецепторов
ниже уровня 60 %. Такое нарушение существовавших к тому моменту представлений о закономерностях действия АПП привело к тому, что препараты с такими свойствами получили название “атипичных”, а базовая дофаминовая теория шизофрении потребовала пересмотра с учетом новых данных.
Вслед за клозапином появились новые АПП этой группы: кветиапин, оланзапин, а также рисперидон, палиперидон (активный метаболит рисперидона) и ряд других. Было отмечено, что АПП второго поколения являются антагонистами не только дофаминовых, но и серотониновых рецепторов.
Предполагается, что в данном случае серотонинергическая система оказывает дополнительное влияние на дофаминовые синапсы, тем самым усиливая основное действие препарата. Благодаря таким особенностям атипичные АПП отличаются минимальным риском возникновения нейроэндокринных и экстрапирамидных расстройств, что позволяет исполь зовать их длительными курсами, не прибегая к снижению дозы или назначению дополнительных препаратов.
Появление атипичных АПП определило переход к новым стандартам переносимости и безопасности. Обладая сравнимыми с типичными нейролептиками показателями терапевтической эффективности, атипичные АПП являются предпочтительными на всех этапах фармакотерапии (основном, поддерживающем и профилактическом) благодаря значительно более низким показаниям развития клинически значимых побочных эффектов. Кроме того, атипичные АПП нередко оказываются эффективными в случаях резистентности к традиционным нейролептикам.
Клинико-фармакологические характеристики распространенных атипичных антипсихотических средств
Оланзапин. Подобно клозапину, оланзапин характеризуется высоким аффинитетом к H1-рецепторам, серотониновым 5HT2A и 5HT6 и ацетилхолиновым рецепторам 1–4-го типов при сохраняющейся высокой активности в отношении дофаминовых D2- и D3-рецепторов. В отличие от клозапина оланзапин не влияет на формулу крови и не требует регулярного контроля анализов. Средний диапазон терапевтических доз оланзапина составляет 10–15 мг/сут в большинстве клинических исследований и 10–20 мг/сут в соответствии с клиническими стандартами. Таким дозировкам соответствует 70–80 % оккупированных D2-рецепторов [15, 19]. Более высокие дозировки (30–40 и даже 50 мг/сут) применялись в исследованиях для оценки эффективности, но не рекомендуются для практического использования в связи с возможностью развития выраженной седации, экстрапирамидных и эндокринных нарушений, а также из-за исчезновения прямых корреляций между концентрацией препарата и выраженностью клинического эффекта [5, 21]. Пик концентрации препарата в плазме крови находится в диапазоне 5–8 часов. Средний период полувыведения, равный 33 часам, предполагает однократный прием препарата в течение суток. Не отмечено и отрицательного влияния оланзапина на показатели сердечной проводимости, что на практике подразумевает отсутствие необходимости в регулярном мониторинге ЭКГ при терапии оланзапином [22].
Основной путь метаболизма оланзапина – печеночный. При этом показано, что заболевания печени не
приводят к значительному изменению фармакокинетики оланзапина. Дисфункция почек также не является основанием к особому режиму его применения или дозирования [4, 9, 26]. Препарат в основном метаболизируется с участием изоэнзима CYP1A2; дополнительный метаболизм обеспечивается изоэнзимом CYP2D6. Сам оланзапин не является ингибитором изоэнзимов системы цитохрома P450. Примерно 60 % принятой дозы выводится почками; 30 % – через кишечник. Клиренс оланзапина в женском организме примерно на 25 % ниже, в результате чего концентрация препарата у женщин на 60–85 % превышает аналогичный показатель у мужчин. Возможным механизмом этого является более низкая активность CYP1A2 у женщин [7, 20].
К настоящему времени определены варианты лекарственного взаимодействия, приводящего к заметному изменению концентрации препарата [3]. Указывается, что у пациентов, получающих одинаковые дозы оланзапина, его содержание в плазме может отличаться многократно. Эти индивидуальные отличия в метаболизме могут быть обусловлены рядом факторов, включая генетические. Одним из факторов, требующих своего учета при назначении терапии, называется курением табака. Механизм этого взаимодействия связан с потенцирующим действием табака на изоэнзим CYP1A2, в результате чего метаболизм оланзапина ускоряется, а его концентрация в плазме оказывается ниже ожидаемой [16]. Указывается, что потребление более 5 сигарет в день является достаточным поводом к увеличению дозы оланзапина в полтора-два раза [32]. Аналогичный эффект зарегистрирован при совместном назначении оланзапина с солями лития [6]. С другой стооны, совместное назначение оланзапина с препаратами-ингибиторами CYP1A2, такими как флувоксамин или
ципрофлоксацин, приводит к увеличению концентрации оланзапина [18, 24, 31]. Совместный прием флуоксетина и оланзапина не приводит к значительному изменению клиренса последнего, поскольку флуоксетин является ингибитором CYP2D6, отвечающего лишь за дополнительный метаболический
путь оланзапина (Gossen, 2002).
Основной метаболит оланзапина –N-дезметилоланзапин, как предполагается, не обладает сколь-либо
значимой фармкологической активностью в отношении серотониновых и дофаминовых рецепторов, однако предположительно играет существенную “балансирующую” роль в формировании метаболических эффектов, вызванных оланзапином; таким образом, их выраженность определяется соотношением концентраций неметаболизированного оланзапина и N-дезметилоланзапина [7, 27]. Обычно это соотношение составляет 1 : 5, но в ряде случаев, например при приеме некоторых контрацептивов, может изменяться в сторону увеличения [17].
Кветиапин представляет собой соединение из группы дибензотиазепина и структурно сходен с эталонным клозапином, в силу чего обладает рядом сходных с ним фармакологических свойств. Кветиапин обладает сродством к D1-, D2-, 5-HT1A-,5-HT2A-, α1- и α2-адренергическим
рецепторам. У препарата выражены антигистаминные свойства, несколько меньше – способность блокировать α1-адренергические, 5-НТ2А-серотонинергические и α2-адренергические рецепторы. С D2-дофаминергическими, 5-НТ1А-серотонинергическими и D1-дофаминергическими рецепторами кветиапин взаимодействует слабо. С холинергическими рецепторами типа М1 он практически не
связывается. Наиболее характерным для кветиапина традиционно считают выраженный седативный эффект. Среди аналогичных препаратов он уступает лишь эффекту клозапина и обусловлен высоким тропизмом к α1- и α2-адренорецепторам и блокадой H1-рецепторов, что обусловливает предпочтительность его использования при острых психотических состояниях, протекающих с возбуждением и тревогой.
Не менее важным представляется способность препарата оказывать антиагрессивное действие. Данное свойство позволяет ряду авторов рекомендовать кветиапин при широком круге состояний, включающих острые шизофренические психозы, протекающие с психомоторным возбуждением, враждебностью и агрессией, психозы позднего возраста, психопатопободные состояния с импульсивным поведением. Отмечается, что в этом качестве препарат оказывает выраженный, упорядочивающий поведение “социализирующий эффект”: даже при сохраняющейся галлюцинаторно-бредовой симптоматике быстро редуцируется дезорганизованное поведение.
Эффективность кветиапина при острых маниакальных состояниях установлена на уровне, не отличающемся от уровня препарата сравнения (галоперидол), при практическом отсутствии в отличие от последнего нежелательных явлений, включая экстрапирамидные расстройства, гиперпролактинемию и др. Выбор кветиапина в таких случаях избавляет от необходимости применения бензодиазепинов для купирования психомоторного возбуждения [23]. Среди дополнительных эффектов препарата в первую очередь следует обратить внимание на отмечаемый многими авторами антидепрессивный эффект, проявляющийся снижением не только собственно аффективных расстройств, но и уровня тревоги, напряженности и ряда негативных нарушений.
С учетом того что до 60 % пациентов, страдающих шизофренией, в течение заболевания переносят депрессию (включая постпсихотические и т. н. фармакогенные депрессии), важно отметить, что применение кветиапина этой категорией пациентов позволяет в ряде случаев избегать назначения сопутствующей антидепрессивной терапии [8].
При назначении кветиапина следует придерживаться следующих рекомендаций:
• эффективная дозировка препарата варьируется в пределах 75–400 мг дважды в сутки (у пожилых пациентов 25–75 мг дважды в сутки);
• в клинической практике чаще применяется 2-кратный прием в течение суток, который в случаях использования небольших дозировок при поддерживающей терапии (100–400 мг/сут) может быть заменен однократным приемом;
• при повышении дозировок препарат может эффективно использоваться для терапии острых психотических состояний, в т. ч. протекающих с ажитацией, включая случаи лекарственной резистентности;
• терапевтические дозировки 300–400 мг/сут рекомендуется достигать примерно к пятому дню терапии, начиная с дозировки 50 мг в первый день (Stahl, 1999).
Характерная особенность кветиапина состоит в том, что даже при назначении максимальных дозировок более 800 мг/сут количество оккупированных D2-рецепторов не превышает уровня 70 %, следствием чего является наименьшая по сравнению с другими АПП частота таких побочных эффектов, как экстрапирамидные и нейроэндокринные нарушения [29].
Рисперидон – производное бензизоксазола. Его низкое сродство к Н1-рецепторам обусловливает слабый седативный эффект препарата, отсутствие выраженного повышения аппетита и массы тела. Рисперидон также не обладает сродством к холинергическим рецепторам, в связи с чем для него не характерно появление периферических (нарушение зрения, сухость во рту, запоры, задержка мочеиспускания, обусловленная спазмом сфинктера и атонией мочевого пузыря, задержка эякуляции, нарушения аккомодации) и центральных (утяжеление когнитивных расстройств) антихолинергиче-
ских эффектов. Рисперидон метаболизируется ферментом цитохромом Р450 2D6 до 9-гидроксирисперидона (палиперидона), который обладает аналогичным рисперидону фармакологическим действием и в настоящее время прошел регистрацию в качестве самостоятельного препарата. Период его полувыведения составляет около 3 часов; палиперидона – 23 часа. Равновесная концентрация рисперидона в организме достигается в течение 1 дня, палиперидона – 4–5 дней. Выведение обоих препаратов из пожилых пациентов и пациентов с почечной недостаточностью замедлено, в то время как концентрации рисперидона в плазме у пациентов с печеночной недостаточностью остаются нормальными.
Экстрапирамидные неврологические побочные эффекты рисперидона носят четкий дозозависимый характер, возникают либо уже в начале терапии, либо при повышении дозировки. В дозах до 8–10 мг/сут их частота не отличается значимо от таковой для других атипичных АПП. Последующее повышение дозировки рисперидона обычно приводит к необходимости назначения корректирующей терапии. Гипотензивный эффект представлен минимально. В дозах 1–2 мг/сут препарат обладает активирующим действием, в связи с чем в начале терапии может отмечаться нарушение сна.
Тактика назначения антипсихотической терапии
При проведении антипсихотической терапии выделяют три этапа (рис. 3):
• купирующая или активная терапия, направленная на быстрое устранение психотической симптоматики. Продолжительность: 4–12 недель;
• долечивающая, стабилизирующая или поддерживающая терапия, имеющая целью подавление резидуальной продуктивной симптоматики, коррекцию негативных нарушений,
восстановление социально-трудовой адаптации и предотвращение или лечение ранних рецидивов. На этом этапе дозировки постепенно снижаются с целью уменьшения седативного эффекта нейролептика. Продолжительность: 3–9 месяцев;
• противорецидивная или профилактическая терапия проводится для предотвращения развития новых
приступов и замедления темпа прогредиентности заболевания.
Рисунок 3. Этапы антипсихотической терапии.
Проводится неопределенно долго, но не менее 1–2 лет.
Каждый из указанных этапов предъявляет свои требования к назначаемому нейролептику. Если на первом этапе активной терапии определяющими являются выраженность антипсихотического действия и скорость наступления терапевтического эффекта, на втором этапе на первый план выходят способность препарата влиять на негативную симптоматику и возможность плавного изменения дозировок. Существенную роль играют и дополнительные терапевтические эффекты
препарата, что позволяет избегать комбинаций с другими лекарственными средствами для купирования коморбидных нарушений. Для третьего этапа антипсихотической терапии наиболее
важными являются положительные профили безопасности и переносимости препарата, а также фармакоэкономические факторы.
Вопросы смены антипсихотической терапии
Необходимость смены терапии, обусловленная недостаточной эффективностью или неудовлетворительной переносимостью первоначально назначенного АПП, возникает достаточно часто. При этом необходимо учитывать тот факт, что сам момент “переключения” одного АПП на другой является критическим в отношении как психотической или побочной симптоматики, так и уровня лекарственной приверженности. Именно к событиям начала или смены антипсихотической терапии приурочено наибольшее число отказов от лечения. С учетом этого при смене терапии
должна быть сохранена интенсивность терапевтического воздействия, с одной стороны, и соблюдены правила минимизации нежелательных последствий этой смены, с другой [10, 11].
Предложено четыре варианта смены препарата антипсихотической терапии:
• назначение нового препарата с последовательным достижением эффективной терапевтической дозы и постепенной отменой предыдущей терапии;
• одномоментное прекращение предыдущей терапии с одновременным назначением новой;
• постепенная титрация нового препарата с одномоментной отменой старого;
• постепенная отмена предыдущей терапии с назначением нового препарата сразу в полной дозе.
Каждый из этих вариантов имеет свои преимущества и недостатки в зависимости от конкретной ситуации с приоритетом подхода, предполагающего наилучшее соотношение эффективности/безопасности. При отмене предыдущей терапии рекомендуется учитывать возможность возникновения различных вариантов лекарственного рикошета (например, рикошетной дискинезии).
Исследования, в которых сравнивали четыре указанных подхода при замене типичных нейролептиков
(таких как галоперидол) на оланзапин, показали, что наиболее предпочтительным в плане эффективности и безопасности является вариант с постепенной отменой галоперидола и одновременным одномоментным назначением оланзапина в терапевтической дозе. К его преимуществам перед другими вариантами относились как эффективная редукция показателей, так и положительный профиль экстрапирамидной симптоматики, редуцировавшейся в результате проведенной замены. Указывается, что именно постепенная отмена первоначально назначенного АПП позволяет минимизировать вышеупомянутые риски, связанные с возможностью возникновения “лекарственного рикошета” [22, 12].
Тактика замены препаратов при проведении антипсихотической терапии состоит из следующих этапов:
1. Назначение атипичного АПП.
2. Постепенная отмена ранее назначенного антипсихотика.
3. Подбор оптимальной дозы атипичного АПП.
4. Мониторинг и при необходимости коррекция транзиторных побочных эффектов.
При необходимости замены АПП длительного действия (депонированные формы) на атипичный антипсихотик рекомендуется тактика перекрестной замены. Показано, что постепенная перекрестная титрация обоих препаратов в течение месяца переносится лучше, чем другие подходы, предусматривающие одномоментную отмену первоначального препарата или одномоментное назначение вновь назначенного антипсихотика. В одном из исследований пациенты, получавшие Галоперидол деканоат или Флуфеназина деканоат в течение по меньшей мере трех лет,
переводились на пероральный оланзапин либо продолжали первоначальную терапию. Процесс замены препарата проходил в течение месяца с последующей двухмесячной оценкой результатов замены. Обнаружено, что у пациентов, переведенных на перораральную форму, не было зарегистрировано увеличения числа нежелательных явлений по сравнению с контрольной группой, продолжившей
первоначальную терапию. С другой стороны, пациенты, переведенные на оланзапин, показали существенное снижение показателей PANSS (Positive and Negative Syndrome Scale) по сравнению с контрольной группой. Субъективная оценка показала также, что пациенты предпочитали пероральный оланзапин пролонгированным инъекционным формам типичных нейролептиков [25].
В большинстве случаев эффект от замены типичных нейролептиков на пероральные атипичные АПП проявляется в снижении выраженности психотической симптоматики наряду с уменьшением экстрапирамидных расстройств, включая симптомы поздней дискинезии. К другим преимуществам этой замены относятся повышение уровня лекарственной приверженности и улучшение общего прогноза.
Тактика замены препаратов пролонгированного действия при проведении антипсихотической терапии состоит из следующих этапов:
1. Назначение атипичного АПП в минимальной начальной дозе.
2. Постепенное снижение дозы ранее назначенного пролонгированного АПП в течение месяца.
3. Подбор оптимальной дозы атипичного АПП.
4. Мониторинг и при необходимости коррекция транзиторных побочных эффектов.
5. Дальнейшее динамическое наблюдение за состоянием.
Назначение АПП при лечении шизофрении и биполярного
расстройства
При назначении активной терапии главной ее целью является редукция основной психотической симптоматики галлюцинаторно-бредового круга, купирование ажитации и других нарушений поведения. В большинстве случаев выбор АПП не зависит от выбранного режима лечения (стационарного или амбулаторного). В последние десятилетия интенсивность фармакологического лечения последовательно возрастала; при этом предполагается, что перерывы в антипсихотической терапии после достижения первоначальной ремиссии в значительной степени ухудшают прогноз в отношении общего течения заболевания. Аналогичным образом раннее начало терапии считается фактором, способным в существенной мере повлиять на последующий исход.
Стоит отметить, что появление новых АПП сделало первоначальный выбор основного лекарственного средства достаточно сложным и комплексным решением, требующим учета большого числа разнородных факторов. По сравнению с типичными нейролептиками, обладающими сходным профилем действия (кроме побочных эффектов), новые препараты (рисперидон, кветиапин и оланзапин) отличаются улучшенным профилем безопасности и переносимости. Кроме того, в ряде случаев их эффективность оказывается предпочтительной. Эти аргументы могут стать решающими при выборе
терапии уже на ранних этапах, особенно при ее назначении пациентам с низким уровнем лекарственной приверженности (рис. 4–5).
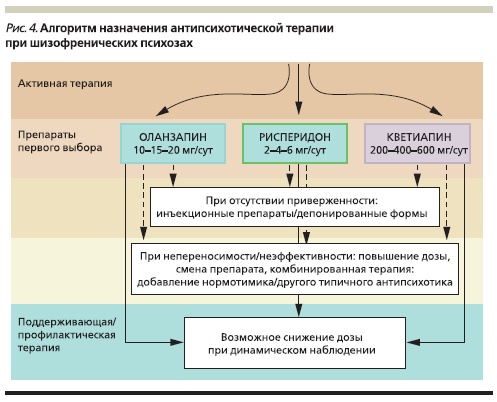
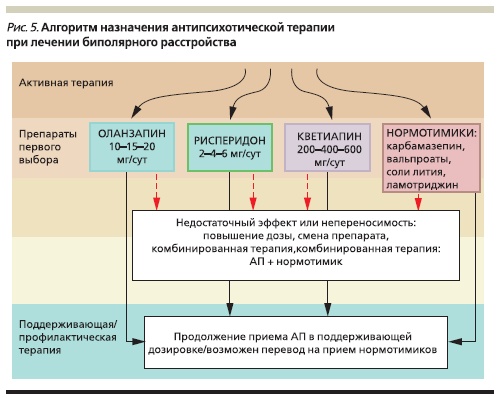
Бо́льшая эффективность АПП нового поколения предполагает, что их выбор в большинстве случаев является оправданным. Потребность в смене антипсихотической терапии возникает при наличии выраженных побочных эффектов (например, эстрапирамидных симптомов при применении
рисперидона или увеличении массы тела на фоне оланзапина/кветиапина) или если терапевтический ответ может быть оценен как неадекватный. В целом временны́е рамки для принятия решения о неэффективности препарата ограничиваются сроком от нескольких дней до 3–4 недель.
Отсутствие ответа на проводимую терапию требует от клинициста оценки возможных факторов, оказывающих негативное влияние на терапевтический эффект. В их числе стоит отметить плохую лекарственную приверженность (пациент не принимает лекарства, но по тем или иным причинам не сообщает об этом врачу) или нарушение метаболизма препарата, вызванное действием дополнитель-
ных агентов, обладающих фармакологической активностью (таких как никотин). Решение о замене препарата или назначении комбинированной терапии должно приниматься только после исключения этих возможных влияний.
Длительная антипсихотическая терапия
Поддерживающая терапия с последующим переходом к профилактической начинается после минимизации психотической симптоматики. На этом этапе часто возникает вопрос:является ли необходимым продолжение терапии при отсутствии или минимальной выраженности остаточной симптоматики? Такого рода вопросы задаются не только самими пациентами, но и специалистами.
В связи с этим необходимо отметить, что первоначальной целью поддерживающей и профилактической терапии является минимизация риска рецидива, а общая длительность должна
согласовываться с этими требованиями и составляет от нескольких месяцев до нескольких лет. Поскольку при применении атипичных АПП риск развития таких побочных эффектов, как поздняя дискинезия, по сравнению с типичными нейролептиками минимален, вопрос о сохранении баланса эффективность/безопасность при назначении поддерживающей терапии можно считать решенным в
пользу необходимости ее проведения. В случае если дозировка основного АПП во время активной терапии была высокой, при переходе к поддерживающей терапии она обычно снижается. Такая тактика обычно оправданна при выраженном приступообразном течении заболевания с четко
очерченными периодами обострения (что более характерно для аффективных или аффективноредовых эпизодов в рамках биполярного или шизоаффективного расстройства). При ее выборе следует избегать интермиттирующего приема АПП с перерывами и последующими возобновлениями приема, поскольку эффективность терапии при этом заметно падает [11].
При более заметной тенденции к континуальному течению заболевания с наличием широкого круга остаточных симптомов (включая негативные), а также если дозировка препарата в период активной терапии была невысокой (для оланзапина: 5–15 мг/сут), такое снижение может оказаться нецелесообразным [28].
Появление атипичных АПП обозначило еще одну важную точку приложения поддерживающей терапии: негативные расстройства и симптомы когнитивного дефицита. Высокая эффективность атипичных антипсихотиков в отношении негативной симптоматики определяет необходимость длительной поддерживающей терапии для достижения уровня деятельности пациента, максимально близкого к таковому до болезни.


