Сегодня уже достоверно известно, что атопический дерматит (АД) – это хроническое воспалительное заболевание кожи с очень сложным патогенезом. Его развитие зависит от нескольких факторов, в т. ч. генетических, внешнесредовых, аллергических, инфекционных и, возможно, аутоиммунных [1]. Сложное взаимодействие всех этих факторов индуцирует сложную воспалительную реакцию в коже с участием Th2-клеток, при которой дендритные клетки играют наиболее важную роль во взаимодействии факторов внешней среды с врожденной и адаптивной иммунной системами.
Мутация гена филаггрина у больных АД повышает риск возникновения одного из кардинальных симптомов болезни – постоянно сухой кожи, и считается также причиной нарушения ее барьерной функции, что повышает чрескожную абсорбцию аллергенов, инфекционных агентов и т. п. Сложный профиль цитокинов, синтезируемых в различных клеточных источниках (например, кератиноцитах), играют важную роль в развитии ранней активации Т-клеток через дендритные клетки, включая клетки Лангерганса. Th2-клеточно-опосредованное воспаление в поврежденной коже вносит свой вклад в дисфункцию эпидермального барьера кожи, увеличение уровня интерлейкина-31 (ИЛ-31), который усиливает зуд и влияет на дифференцировку кератиноцитов, и т. п. Установлено, что увеличение уровня интерферона γ способствует апоптозу кератиноцитов. В то же время показано, что эти эффекты могут быть компенсированы ИЛ-10. Недавно были также получены свидетельства повышения при АД экспрессии гена ИЛ-17 в коже [1].
Все вышесказанное – лишь очень малая доля тех современных научных данных, которые ясно свидетельствуют об одном: АД – это болезнь со сложнейшим этиопатогенезом. Если вкратце описать последние достижения в лечении АД, можно указать на использование пробиотиков или бактериальных лизатов на ранних стадиях болезни (находится в стадии активных исследований); аллерген-специфическую иммунотерапию (раньше АД не рассматривался как показание к ее назначению); фототерапию, назначаемую с целью снижения системной иммунной активации. Несколько лет назад зарубежные ученые установили, что зуд и активацию тучных клеток можно контролировать у больных АД с помощью т. н. проактивной терапии [1].
Установлено, что более 70 % больных АД имеют легкую степень тяжести заболевания: около 20 % – умеренную и 2 % – тяжелую [2].
Согласно данным недавно опубликованного обзора Р. Arkwright и соавт. (2013) по лечению тяжелого АД, к числу больных этой формой заболевания относят не чувствительных к обычным увлажняющим средствам и глюкокортикостероидам (ГКС) с умеренной активностью [2]. В этой публикации были сформулированы основные причины тяжелого, упорно-рецидивирующего течения АД. В дальнейшем мы будем часто обращаться к данному обзору.
Основные причины неэффективности лечения АД
Итак, почему лечение АД бывает неэффективным и болезнь протекает в тяжелой форме?
При поисках ответов на эти вопросы авторы цитируемого обзора предлагают убедиться, во-первых, в правильности диагноза АД, во-вторых, в приверженности пациента лечению, а также исключить вторичные инфекции кожи и т. п. [2].
Достаточно редкой, но важной причиной неэффективности лечения АД является неправильный диагноз. В настоящее время диагноз АД основывается на критериях Hanifin и Raika (наличие 3 из 4 главных признаков заболевания: зуд, типичное расположение сыпи, хроническое течение болезни, анамнестически – атопия у пациента и наследственная отягощенность по атопии в семье; а также по меньшей мере 3 малых критериев) [2].
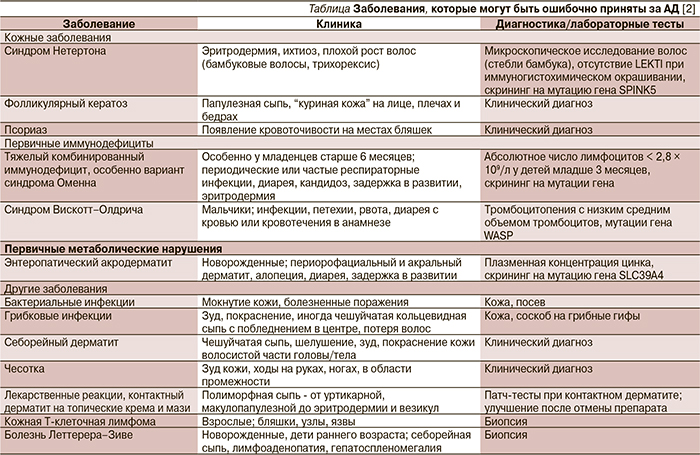
Заболевания, с которыми следует дифференцировать АД, перечислены в таблице. В основном это первичные иммунодефицитные состояния, которые могут протекать с клиническими проявлениями АД; метаболические заболевания, а также кожные инфекции, злокачественные опухоли и реакции на лекарства. Сыпь, не типичная для АД (по расположению очагов и их распространенности; отсутствие зуда или плохой ответ на лечение топическими мазями), наличие указаний на системные инфекции или хронические желудочно-кишечные заболевания, необычный семейный анамнез должны настроить врача на поиск альтернативных АД-диагнозов.
Еще одной причиной неэффективности лечения тяжелой формы АД специалисты считают недостаточные знания пациентов об АД, что приводит к низкой приверженности лечению, при этом особо подчеркивается важность программ обучения. К сожалению, в практике лечения российских больных значение этого фактора недооценивается.
Многочисленными зарубежными исследованиями убедительно доказано, что более чем у половины больных АД, направленных к специалисту, причиной неэффективности лечения является неадекватная терапия [2]. Поскольку врачи часто не имеют достаточно времени для обучения пациентов и ухаживающих за ним лиц правильному применению мазей и кремов, это отрицательно сказывается на приверженности больных лечению. Так, по данным опроса, только 3 из 51 родителя, посетившего специалиста, получили объяснения о причинах AД у их ребенка, или им продемонстрировали, как правильно проводить наружное лечение [3].
Очевидно, больным или их родителям желательно предоставить письменный план терапевтических действий, что будет способствовать лучшему пониманию информации, предоставленной на консультации. Во многих странах (США, Канада, Великобритания) больных АД дополнительно обеспечивают специальной литературой, а медсестра дерматолога или аллерголога-иммунолога демонстрирует больным, в какой последовательности и как наносить на кожу назначенные врачом лекарства.
В обобщенном виде основные причины неэффективности терапии АД можно представить следующим образом [2]:
- Лекарства недоступны, пациент избегает прием лекарств и не идет к врачу для их выписки; врачи не прописывают адекватное количество лекарств из-за озабоченности по поводу их токсичности или стоимости.
- Лекарства доступны, но не используются в полной мере:
- пациент/родители не знают о правильной частоте приема и типе лекарств, которые могут быть использованы для эффективного лечения АД;
- пациенту/родителям не хватает мотивации: AД протекает сравнительно легко;
- пациент/родители имеют мало времени на лечение;
- нанесение препаратов на кожу разрешают самим детям, которые слишком неопытны, чтобы эффективно применять лекарства;
- у пациента/родителей есть мнение, что лечение неэффективно;
- пациент/родители считают, что лечение сопровождается неприемлемыми побочными явлениями;
- пациент/родители считают, что лечение косметически неприемлемо (например, блестящие или жирные мази, наносимые на лицо подростками);
- лекарства ухудшают течение АД;
- нанесение лекарств на кожу сопровождается дискомфортом.
Еще несколько лет назад в числе важных причин тяжелого течения АД американские ученые назвали гиперчувствительность/аллергию на применяемые в лечении наружные препараты.
Наполнители или сами активные ингредиенты топических препаратов могут непосредственно вызывать раздражение кожи из-за химической или иммунной гиперчувствительности. Например, мочевина, которая входит в состав смягчающих средств, может вызывать жжение; нанесение мази такролимуса или крема пимекролимуса в начале лечения может сопровождаться кратковременным жжением и эритемой (обычно от 3 до 5 дней). Тиолы, первичные амины, алкены и алкилгалогениды способны образовывать ковалентные связи с поверхностно-связанными белками на мембранах кератиноцитов, что может приводить к развитию реакции гиперчувствительности замедленного типа [4]. Потенциальным аллергическим действием обладают и другие химические вещества – пропиленгликоль, формальдегид и сорбитансесквиолеат, широко используемые в смягчающих мазях, а также стабилизатор этилендиамин, включенный в состав некоторых галогенированных ГКС (гидрокортизона 17-бутирата и бетаметазона 17-валерата) [5].
Пациенты, у которых после нанесения мази или крема ухудшается течение АД, должны быть обследованы с помощью патч-тестов. Их, как правило, проводят дерматолог и аллерголог с использованием стандартных (50 и более) химических веществ. К сожалению, использовавшаяся ранее в РФ патч-тест-система, производимая компанией Nycomed, в настоящее время более не доступна. Как показывают зарубежные исследования, наиболее распространенной причиной контактных реакций гиперчувствительности являются 5 химических гаптенов: сульфат никеля, ароматическая смесь I, п-фенилендиамин, тиомерсал и хлорид кобальта [2].
Если клиницисты уверены в адекватности проводимой терапии, но течение болезни не улучшается, следует исключить инфекции кожи, которые могут сопровождать АД.
Кожа большинства пациентов с AД обсеменена золотистым стафилококком, который является источником экзотоксинов. Идентифицировано несколько видов суперантигенов стафилококка (стрептококки – менее распространенный триггер) [6]. Клиническими признаками, свидетельствующими о вторичной бактериальной инфекции кожи, являются: 1) мокнущие, болезненные участки поражения кожи, корочки; 2) асимметричное распределение очагов поражений; 3) системное поражение органов.
Другие микробы тоже могут быть причиной обострений АД. В частности, при появлении у больных мономорфных везикулярных высыпаний следует исключить вторичное инфицирование кожи вирусом простого герпеса. Это одна из чрезвычайных ситуаций в клинической дерматологии, которая требует незамедлительного назначения такому пациенту системной противовирусной терапии [7]. Грибы вида Malassezia находят у 75 % взрослых пациентов с АД, особенно с локализацией сыпи в области головы и шеи [8]. У детей грибковое поражение в большей степени связано с себорейным дерматитом, чем с AД.
Обострения АД, связанные с питанием, встречаются примерно у трети маленьких детей, 5–10 % детей старшего возраста с умеренной и тяжелой формами АД, но очень редко – у взрослых [9]. Подтвердить участие пищевых аллергенов в обострении АД крайне сложно. Диагностика аллергических реакций немедленного типа на пищевые продукты (крапивница и отек Квинке) не представляет трудностей по данным анамнеза. Однако даже в случаях, когда обострение АД связано с приемом определенного пищевого аллергена, результаты определения специфических IgE-антител могут быть ложно-отрицательными [10]. Напомним, что пациенты с АД могут при этом иметь очень высокий уровень общего IgE в сыворотке крови.
Даже т. н. стандартизированные атопические патч-тесты (на белок коровьего молока, клещей домашней пыли, пыльцу деревьев и трав) оказались недостаточно точными, чтобы рекомендовать их для рутинного прогнозирования связи обострений АД с пищевой аллергией [2].
Диагноз индуцированного пищей обострения АД следует подтвердить с помощью 4-недельной элиминационной диеты, когда больному исключают прием определенных продуктов питания, что должно привести к существенному ослаблению симптомов АД.
Между тем Кокрановский обзор 9 рандомизированных контролируемых исследований показал, что исключение из рациона молока и яиц, нескольких пищевых продуктов и даже элементная диета не эффективны в общей популяции больных АД [11]. Однако в отдельных случаях некоторые пищевые аллергены могут быть важными триггерами. Например, есть данные, свидетельствующие, что исключение яиц из питания больных с соответствующей аллергией приводит к снижению тяжести АД [6, 11].
У детей раннего возраста, страдающих АД, которые не реагируют на смягчающие средства и ГКС умеренной активности, следует на 3–4 недели исключить коровье молоко и назначить смеси с высокой степенью гидролиза. Следует отметить, что с возрастом большинство детей становятся толерантными к протеинам молока, яиц и пшеницы.
Немецкие ученые когда-то назвали АД “астмой кожи”. Действительно, пылевые клещи и другие аэроаллергены часто также рассматриваются как триггеры АД [12]. Хотя результаты исследований по влиянию стандартных мероприятий, направленных на устранение/снижение накопления пылевых клещей в быту, на тяжесть АД противоречивы [2], их соблюдение все же следует рекомендовать всем пациентам. Особенно это важно для больных с сопутствующей бронхиальной астмой или круглогодичным ринитом, сенсибилизированных к клещам домашней пыли. Необходимо также избегать контактов с домашними животными, особенно в тех случаях, когда с ними связаны обострения атопических заболеваний, включая АД.
Современные подходы к терапии АД
При планировании лечения АД необходимо учитывать ряд особенностей, присущих течению болезни у детей и взрослых.
Хотя в 85 % случаев АД развивается у детей в возрасте до 5 лет, у 2–8 % больных он может начаться во взрослом возрасте, и у таких пациентов следует рассмотреть альтернативные причины заболевания. Связанные с пищей обострения АД более характерны для детей младшего возраста, а у взрослых они относительно редки. С другой стороны, у взрослых, особенно с локализацией очагов поражения на руках, следует исключить фактор раздражения кожи (контакт с парфюмерией, дезодорантами, стиральным порошком, перчатками и украшениями для дома, химическими веществами и пылью на рабочих местах). Грибковые инфекции типа Malassezia более распространены среди взрослых, особенно когда АД локализуется на голове и шее. Если кожные соскобы положительны, показана топическая противогрибковая терапия [8]. Психологические факторы (как дома, так и на рабочем месте) также должны быть рассмотрены, поскольку они поддерживают тяжесть течения АД.
При лечении пациентов с тяжелой формой АД врачу следует попытаться ответить на следующие вопросы [2]:
- Правильно ли поставлен диагноз АД?
- Имеет ли пациент достаточно ясное представление о хроническом заболевании, характеризующемся обострениями/ремиссиями; полностью не излечивается; требует соблюдения соответствующих общих мер?
- Оптимально ли проводимое лечение: низкая приверженность терапии; недолечивание: недостаточное использование гидратирующих средств, неадекватное применение ГКС, наружная терапия не проводится должным образом, финансовые ограничения?
- Имеются ли триггеры АД-инфек-ции: бактериальные (например, Staphylococcus aureus), вирусные (например, Herpes simplex), грибковые (например, Tinea corporis); аллергены: пищевые, ингаляционные; ирританты: детергенты, мыла, химические вещества, консерванты, одежда, тепло?
- Есть ли у пациента какие-либо психологические проблемы (эмоциональные стрессы, тревожность и т. д.)?
Тщательный физикальный осмотр пациента и сбор анамнеза болезни с выявлением возможных триггеров, эффективность используемых лекарственных препаратов в комплексе составляют основу успешной терапии АД. Тяжелых пациентов должны лечить специалисты (дерматологи или аллергологи), имеющие необходимый клинический опыт и использующие наиболее актуальные рекомендации по лечению и профилактике АД (см. рисунок) [2, 13]. Возможность госпитализации должна рассматриваться для пациентов, резистентных к терапии в амбулаторных условиях. Во многих случаях интенсивное обучение таких пациентов, повышение их приверженности терапии, а также лечение вторичных инфекций, исключение контакта с аллергенами и ослабление стресса в совокупности приводят к устойчивому улучшению клинической картины АД. Если диагноз вызывает сомнение из-за наличия атипичных клинических признаков или плохого ответа на лечение, следует искать альтернативные заболевания.

Любой степени тяжести АД начинают лечить со вспомогательной терапии, которая включает очищение и увлажнение кожных покровов с помощью специальных средств гигиены, разработанных для атопичной кожи (например, линия Топикрем, Мустела Стелатопия, Урьяж, Атодерм, Физиогель и т. п.; зеленая зона рисунка) [14]. Очищение и увлажнение кожи являются ключевыми и важными лечебными мероприятиями, направленными на уменьшение сухости кожи, восстановление и поддержание ее гидратации. Показано, что увлажняющие средства обладают даже ГКС-сберегающим действием. Кроме того, благодаря увлажнению кожи абсорбция (следовательно, побочное действие) топических ГКС снижается.
Топические ГКС остаются основой лечения обострений AД. Выбор препарата зависит от локализации и степени тяжести АД. Как правило, в особенности детям, следует с осторожностью назначать ГКС низкой активности, используя “правило фаланги”. Крайне важно правильно подобрать нужную лекарственную форму (крем, лосьон, мазь), что играет значимую роль в абсорбции активной субстанции препарата и может повысить его лечебное действие. Мази более эффективны, чем кремы, поскольку они лучше проникают в кожу, содержат меньше консервантов (следовательно, потенциал раздражения и аллергических реакций у них ниже). При лечении АД преимущественно следует назначать высокоэффективные ГКС с благоприятным профилем безопасности: гидрокортизона 17-бутират, метилпреднизолона ацепонат 0,1 %, мометазона фуроат 0,1 % и т. п.
Поскольку большинство детей страдают АД легкой или средней степени тяжести, для них наиболее приемлемыми топическими ГКС являются гидрокортизон или его производные (их применяют с возраста старше 4 месяцев). С первых месяцев жизни детей разрешено использование мометазона фуроата (Элоком). Если у пациента имеется “влажная” экзема, лучше использовать крем; только при очень сухой коже и в ветреную/морозную погоду назначают мазевую форму ГКС. На лицо и волосистые участки тела следует наносить только эмульсию или лосьон (например, Элоком, Локоид). Обычно несколько капель лосьона наносят на пораженные участки кожи 1 раз в день, после чего втирают его мягкими движениями до исчезновения с поверхности кожи.
Крем или мазь наносят тонким слоем на пораженные участки кожи 1 раз в день. Продолжительность курса лечения определяется его эффективностью, а также переносимостью пациентом, наличием и выраженностью побочных эффектов.
Больным с тяжелой формой АД или при неэффективности препаратов предшествующих классов назначают очень сильный кортикостероид клобетазола пропионат (Дермовейт). Детям до 1 года его применение противопоказано; взрослым пациентам с АД Дермовейт рекомендуют использовать исключительно редко и в течение короткого периода, поскольку после применения 20–30 г препарата уже наблюдается системное действие (супрессия надпочечниковой функции). При тяжелом течении АД у детей младшего возраста следует рассматривать альтернативные диагнозы, оценить возможную роль пищевой аллергии, инфекций кожи, других триггерных факторов.
Пациенты должны быть информированы, как и когда использовать топические ГКС. Правильное их применение 1 или 2 раза в день в соответствующей форме и короткими курсами может устранить многие потенциальные проблемы. Использование ГКС более 2 раз в день повышает вероятность возникновения побочных эффектов, делает лечение более дорогостоящим и не увеличивает эффективность (исключение составляет Локоид, который разрешается наносить на кожу 1–3 раза в день коротким курсом).
Атрофия кожи является наиболее распространенным побочным эффектом топических ГКС. Кроме того, при их применении могут возникать гипопигментация, вторичная инфекция, акне и стрии. Местные побочные явления чаще всего развиваются на лице, шее и в области опрелости (следовательно, на эти области следует наносить только ГКС с низкой активностью). Как только кожные симптомы уменьшаются, частоту использования топических ГКС снижают или назначают препарат с более низкой активностью. Если ответ на ГКС низкой активности оптимален, особенно если очаги поражения расположены на лице, шее, в местах с тонкой кожей, в последующем лечение продолжают антагонистами кальциневрина. Мазь такролимуса (Протопик) назначают детям старше 2 лет с умеренной и тяжелой степенью АД, заболевание у которых не контролируются местными ГКС. Для детей в возрасте от 2 до 15 лет предназначена 0,03 %-ная мазь такролимуса, для взрослых – обе формы препарата (0,03 и 0,1 %). Обычно сначала мазь назначают 2 раза в день в течение 3–4 недель. При достижении улучшения в симптоматике АД частоту применения ингибиторов кальциневрина можно уменьшить до нескольких раз в неделю (длительно). Это т. н. проактивная терапия АД. Топические ингибиторы кальциневрина (пимекролимус и такролимус) не вызывают атрофию кожи и особенно полезны при дерматите лица и век. Они показаны также для лечения обширных очагов поражения кожи. Иногда до назначения ингибиторов калциневрина некоторым пациентам необходимо назначать местные ГКС умеренной/высокой активности в течение 3–5 дней для контроля острых обострений дерматита, особенно при его локализации на конечностях и туловище.
В ряде случаев, несмотря на оптимально мощную терапию, небольшой части пациентов не удается достичь положительной динамики, что требует применения альтернативных методов лечения. Таких больных лучше госпитализировать – это может помочь прояснить причину отсутствия лечебного эффекта (инфекции, сильные аллергены окружающей среды, стресс и т. п.) и назначить правильную терапию.


