Хроническая сердечная недостаточность (ХСН) с сохраненной фракцией выброса левого желудочка (ФВ ЛЖ) является наиболее распространенным осложнением артериальной гипертензии – АГ [1]. Способы фармакотерапии, улучшавшие прогноз больных ХСН со сниженной ФВ ЛЖ, не влияли на исходы у пациентов с ХСН и сохраненной ФВ ЛЖ [2]. В последнем случае главным образом рекомендуется целенаправленно лечить основную патологию [3, 4]. Блокаторы кальциевых каналов не только остаются эффективным средством лечения АГ, но и способны повышать толерантность больных ХСН с сохраненной ФВ ЛЖ к физической нагрузке [5, 6]. Влияние блокаторов кальциевых каналов на прогноз пациентов с ХСН и сохраненной ФВ ЛЖ, согласно данным крупного регистра OPTIMIZE-HF, оценивается как нейтральное [7].
Статины снижали смертность больных ХСН с сохраненной ФВ ЛЖ, по данным мета-анализа 4 проспективных наблюдательных исследований (n=5536) (относительный риск – 0,69 при 95% доверительном интервале от 0,493 до 0,965; р=0,030) [8]. Однако крупных рандомизированных контролируемых исследований принимавших статины пациентов с ХСН и сохраненной ФВ ЛЖ не проводилось. Поэтому статины остаются препаратом с потенциалом улучшения исходов для таких больных.
Цель исследования – сравнение эффективности лечения ХСН с сохраненной ФВ ЛЖ у пациентов с АГ различными блокаторами кальциевых каналов с добавлением и без добавления аторвастатина.
Материал и методы
В исследовании участвовали 167 больных ХСН II–III функциональных классов по Классификации НьюЙоркской ассоциации сердца и сохраненной ФВ ЛЖ на фоне АГ III стадии в возрасте от 48 до 70 лет.
Критерии включения в исследование: АГ в анамнезе, одышка, утомляемость, сердцебиение при физической нагрузке, ФВ ЛЖ 50% и более [4], синусовый ритм; 1-й тип диастолической дисфункции ЛЖ (с замедленной релаксацией), подписанное информированное согласие.
Наличие у пациентов диастолической дисфункции ЛЖ констатировали в соответствии с действующими рекомендациями [9, 10].
В исследование не включали пациентов с гемодинамически значимым поражением клапанов сердца; кардиомиопатиями; перенесенными острыми коронарными синдромами и/или инсультом; синдромом слабости синусового узла; фибрилляцией предсердий; атриовентрикулярной блокадой II–III степеней; вторичными АГ; ожирением (индекс массы тела более 30 кг/м2); заболеваниями органов дыхания с дыхательной недостаточностью; анемией (уровень гемоглобина ниже 130 г/л у мужчин и 120 г/л у женщин); нарушениями функции печени и/или почек; сахарным диабетом, требовавшим инсулинотерапии; непереносимостью применявшихся в исследовании препаратов.
Получено одобрение локального Комитета по этике на проведение исследования.
Лечение АГ проводили, переводя больных на прием периндоприла (Престариум, «Servier», Франция), титруя дозу от 2,5 до 10 мг 1 раз в сутки с добавлением к нему после рандомизации верапамила (Изоптин SR, «Abbott», Германия) в дозе 120–240 мг 1 раз в сутки (n=85) или амлодипина (Норваск, «Pfizer», США) в дозе 2,5– 10 мг (n=82) до достижения и поддержания офисного артериального давления (АД) ниже 140 и 90 мм рт.ст. С учетом высокого риска сердечнососудистых осложнений все пациенты получали рекомендацию принимать аторвастатин (липримар, «Pfizer», США) в дозе 10 мг 1 раз в сутки.
Комплексное обследование больных проводилось исходно и через 12 месяцев подобранной терапии, кроме общеклинического исследования включало стандартную электрокардиографию в 12 отведениях; 6-минутный тест ходьбы; оценку клинического состояния при ХСН (шкала ШОКС в модификации В.Ю. Мареева), оценку качества жизни с использованием Миннесотского опросника (MLHFQ – Minnesota Living with Heart Failure questionnaire); определение концентрации N-концевого предшественника мозгового натрийуретического пептида (NT-proBNP) в крови (на анализаторе СOBAS H 232, «Roche Diagnostics GmbH», Германия), липопротеидов низкой плотности (ЛПНП), эхокардиографию.
Эхокардиографию в М- и В-режиме, импульсно-волновую, в т.ч. тканевую, допплерографию выполняли по стандартным рекомендациям [10, 11] с использованием ультразвуковой системы Aloka Alpha 7 (Япония) и векторного датчика с частотой 2,5 МГц. Размер и объем ЛЖ определяли по методу Simpson. Рассчитывали объем левого предсердия (ЛП), ФВ ЛЖ в автоматическом режиме с помощью интегрированного программного обеспечения, массу миокарда ЛЖ – по формуле R.B. Devereux.
Для оценки диастолической функции ЛЖ использовали максимальные скорости раннего диастолического наполнения (Е) и наполнения в систолу предсердий (А), их соотношение (Е/А), время изоволюмического расслабления ЛЖ (IVRT), время замедления кровотока раннего диастолического наполнения (DТ). Показатели Е, А и DT оценивались из апикального доступа в проекции четырехкамерного сечения с помощью импульсно-волновой допплерографии, при размещении контрольного объема между концами створок митрального клапана. Максимальную скорость диастолического подъема основания ЛЖ в раннюю диастолу (e’) определяли при помощи импульсно-волновой тканевой допплерографии из апикального доступа, устанавливая контрольный объем на митральное кольцо в области межжелудочковой перегородки и боковой стенки ЛЖ. Величину е’ получали путем усреднения скоростей из области межжелудочковой перегородки и боковой стенки ЛЖ. Значения отношения E/е’ усредняли из трех последовательных сердечных циклов.
В статистическую обработку включали результаты обследования пациентов, постоянно принимавших назначенные антигипертензивные препараты (допускалось как применение, так и неприменение аторвастатина), используя пакет прикладных программ «STATISTICA 6.1» (StatSoft Inc, США). Образовавшиеся группы проверялись на нормальность распределения с помощью одностороннего теста Колмогорова–Смирнова. Все данные представлены в виде средней арифметической (М), стандартного отклонения средней арифметической (SD). Достоверность различий показателей по количественным признакам определяли по t-критерию Стьюдента, по качественным – с использованием χ2-критерия, признавая их статистически значимыми при р<0,05.
Результаты исследования
Влияние антигипертензивной терапии, включавшей верапамил или амлодипин, на клинический статус и параметры эхокардиографии у пациентов с АГ и ХСН с сохраненной ФВ ЛЖ проанализированы нами ранее [5]. В группе лечения верапамилом аторвастатин постоянно принимали 43 (50,6%) из 85, в группе амлодипина – 40 (48,8%) из 82 пациентов. Это позволило провести сравнение результатов лечения в подгруппах, получавших и не получавших статин.
В табл. 1 и 2 представлены характеристики пациентов, рандомизированных для терапии верапамилом или амлодипином в сочетании с аторвастатином или без него. Обследованные пациенты образовавшихся подгрупп оказались сопоставимыми по ряду показателей.
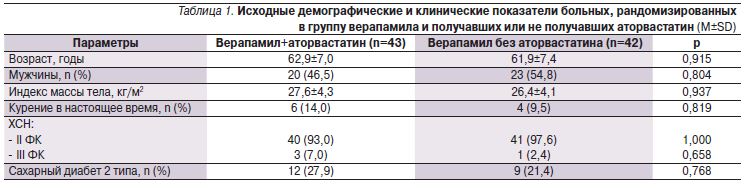
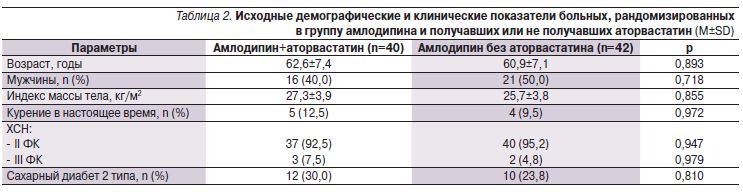
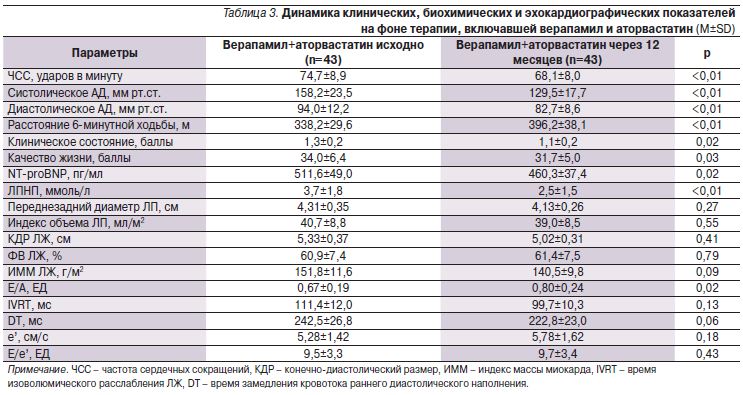
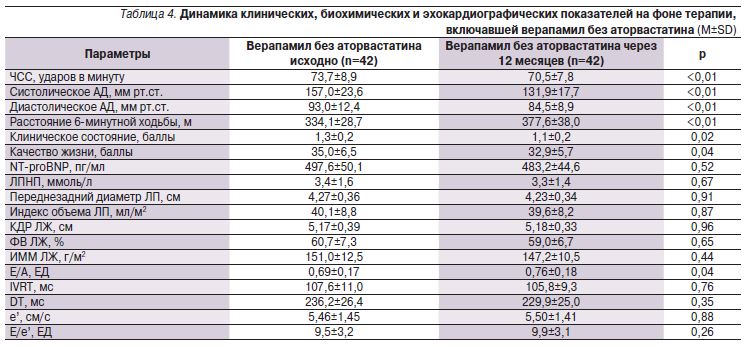
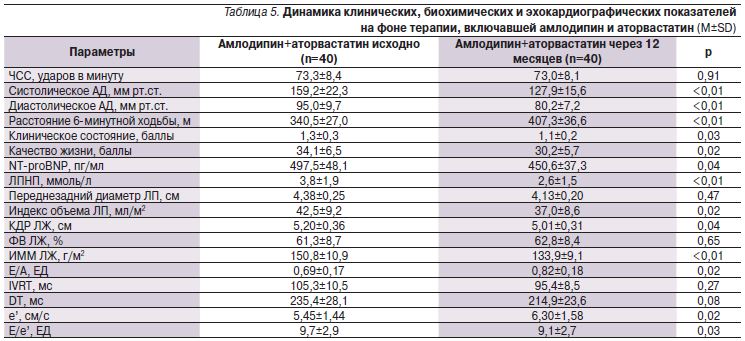
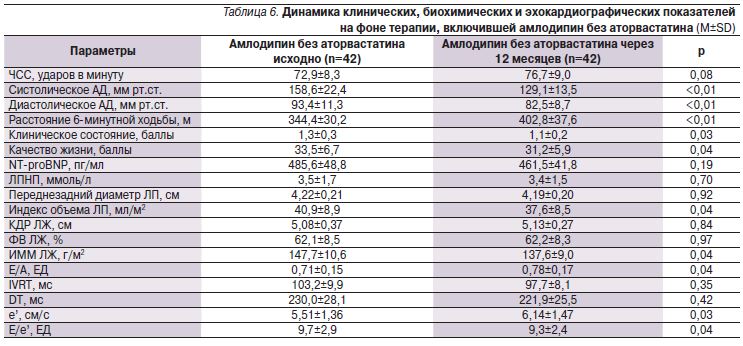
Прием аторвастатина кроме закономерного снижения уровня ЛПНП сопровождался тенденцией к улучшению показателей диастолической функции ЛЖ без существенного изменения других оценивавшихся показателей (табл. 3–6). В подгруппах больных, получавших аторвастатин в сочетании с верапамилом или амлодипином, не отмечено существенного увеличения переносимости нагрузки по сравнению с отказавшимися от приема статина. Так, через 12 месяцев увеличение расстояния, пройденного в тесте с 6-минутной ходьбой, составило 17,1% в группе верапамил+аторвастатин, 13% – верапамил без аторвастатина, 19,6% – амлодипин+аторвастатин, 17,0% – амлодлипин без аторвастатина (p>0,05 для всех сравнений). Необходимо отметить достоверное снижение уровня NT-proBNP в крови, наблюдавшееся только в подгруппах пациентов, принимавших статин, что может ассоциироваться с улучшением прогноза [12]. Значительный регресс гипертрофии ЛЖ регистрировался в группах лечения амлодипином, но не верапамилом независимо от приема аторвастатина.
Обсуждение
Основная область применения статинов – коррекция дислипидемии и предупреждение осложнений атеросклероза [13]. При ХСН особое значение имеют плейотропные эффекты статинов – противовоспалительный, улучшение функции эндотелия путем усиления синтеза оксида азота, ограничение ремоделирования сердца, уменьшение оксидативного стресса [14]. Для больных ХСН с сохраненной ФВ ЛЖ важна способность статинов уменьшать гипертрофию и фиброз миокарда, улучшать его диастолическую функцию [15].
Между тем крупные рандомизированные клинические исследования CORONA [16] и GISSI-HF [17] не выявили положительного влияния розувастатина в дозе 10 мг/сут на прогноз больных ХСН со сниженной ФВ ЛЖ. Однако нельзя было исключить, что нейтральный результат исследований CORONA и GISSI-HF обусловлен применением гидрофильного розувастатина, отличающегося низким уровнем проникновения в миокард. По данным мета-анализа (n=10 966), липофильные статины (в частности, применявшийся нами аторвастатин), в высокой степени поглощающиеся миокардом, способны оказаться более эффективными для больных ХСН [18]. Но в рандомизированном исследовании PEARL (n=574) липофильный питавастатин в дозе 2 мг/сут также не снижал риска смерти от сердечнососудистых причин или госпитализации по поводу декомпенсации ХСН со сниженной ФВ ЛЖ [19]. Для объяснения неэффективности статинов при ХСН со сниженной ФВ ЛЖ предложены гипотезы коэнзима Q (убихинона), липопротеина эндотоксина и селенопротеина [20]. Хотя низкий уровень холестерина ассоциируется с ухудшением исходов у больных ХСН, полагают, что он безопасен, если обусловлен приемом статинов [21].
В нашем исследовании не зарегистрировано смертельных исходов, что не позволяло формировать представление о прогностическом влиянии проведенной терапии. Вместе с тем в ретроспективных и наблюдательных исследованиях пациентов с ХСН и сохраненной ФВ ЛЖ статины достоверно снижали общую смертность [22, 23]. К. Nochioka и соавт. [24] показали, что снижение смертности в когорте больных ХСН с сохраненной ФВ ЛЖ, получавших статины, обеспечивалось уменьшением смертности от инфекций и частоты внезапной смерти. Последнее может быть связано с меньшим числом острых коронарных событий при приеме статинов.
Мы наблюдали лишь тенденцию к улучшению показателей диастолической функции ЛЖ и расстояния в тесте с 6-минутной ходьбой у пациентов, получавших аторвастатин в дополнение к верапамилу или амлодипину. В значительной степени это может быть связано с недостаточной статистической мощностью исследования. Сообщалось о том, что аторвастатин снижал уровень маркеров воспаления, улучшал функцию эндотелия и толерантность к физической нагрузке у больных ХСН со сниженной ФВ ЛЖ [25, 26]. Однако авторы крупного проекта HF-ACTION (n=2331) не получили доказательств улучшения качества жизни и переносимости физической нагрузки при добавлении различных статинов к лечению пациентов с ХСН и сниженной ФВ ЛЖ [27]. В небольшом исследовании SAPHIRE больных ХСН со сниженной ФВ ЛЖ гидрофильный правастатин в низкой дозе (10 мг/сут), но не липофильный питавастатин в высокой дозе (4 мг/сут) значительно увеличивал расстояние в тесте с 6-минутной ходьбой [28]. Показано, что гидрофильные и в еще большей степени липофильные статины (из-за их действия на центральную нервную систему) способствуют усилению ощущения мышечной усталости [29].
Согласно результатам исследования ASCOT-LLA, пациенты с АГ и другими факторами риска сердечно-сосудистых осложнений, у которых во многих случаях имеется ХСН с сохраненной ФВ ЛЖ, получают прогностическую выгоду при добавлении аторвастатина в дозе 10 мг/сут к адекватной антигипертензивной терапии [30]. Через 15 лет после получения этих данных остается неясным влияние статинов на течение и прогноз ХСН с сохраненной ФВ ЛЖ из-за отсутствия соответствующих проспективных рандомизированных контролируемых исследований достаточной статистической мощности.
В настоящее время сложность патогенеза ХСН с сохраненной ФВ ЛЖ и разнообразие ее фенотипических проявлений требуют индивидуального подбора терапии основного заболевания, которым наиболее часто является АГ [31]. Это обеспечивает улучшение клинического состояния пациентов и увеличение их толерантности к физической нагрузке. Добавление к лечению статинов целесообразно в связи с потенциальной возможностью улучшения прогноза больных ХСН с сохраненной ФВ ЛЖ.


