Введение
Бактериальные инфекции дыхательных путей (ИДП; пневмония, инфекционное обострение хронической обструктивной болезни легких – ХОБЛ, острый бактериальный синусит – ОБС) являются одной из наиболее частых причин временной утраты трудоспособности среди взрослого населения. У пациентов старших возрастных групп с сопутствующими заболеваниями (застойной сердечной недостаточностью, сахарным диабетом, алкоголизмом) внебольничная пневмония (ВП) является одной из ведущих причин смерти от инфекционных болезней.
Данные официальной статистики, к сожалению, не отражают истинной распространенности бактериальных ИДП в Российской Федерации. Так, зарегистрированное число случаев ВП в России составляет менее 600 тыс., тогда как, по оценкам экспертов, число пациентов с ВП в РФ ежегодно превышает 1,5 млн [1]. Аналогично, по данным Министерства здравоохранения и социального развития РФ, в России зарегистрировано около 2,5 млн больных ХОБЛ, но эпидемиологические данные позволяют предположить, что их число может составлять около 16 млн человек [2], причем каждый пациент переносит от одного до четырех и более обострений ХОБЛ в течение года [3]. Частой проблемой в амбулаторной практике является и острый бактериальный риносинусит (ОБРС), который развивается как осложнение вирусного риносинусита в 0,5–2,0 % всех случаев острой респираторной вирусной инфекции [4]. Бактериальные ИДП являются показанием к назначению антибактериальной терапии (АБТ), которая купирует инфекционный процесс, предотвращает развитие осложнений
и неблагоприятных исходов, способствует быстрому улучшению состояния пациента.
и неблагоприятных исходов, способствует быстрому улучшению состояния пациента.
Основные возбудители ИДП
Для всех перечисленных бактериальных ИДП характерна общность “типичных” возбудителей. Наиболее значимыми патогенами при ВП,инфекционных обострениях ХОБЛ и ОБРС являются пневмококки (Streptococcus pneumoniae) и гемофильная палочка (Haemophilus influenzae) [5]. При ВП этиологическое значение также имеют “атипичные” микроорганизмы – Mycoplasma pneumoniae и Chlamydophila pneumoniae, а при обострениях ХОБЛ и ОБРС – Moraxella catarrhalis [1, 2, 4]. В табл. 1 представлена структура основных бактериальных возбудителей перечисленных респираторных инфекций.
Таблица 1. Основные бактериальные возбудители ВП, обострений ХОБЛ и ОБРС, %.
В ряде исследований установлено, что ИДП пневмококковой этиологии в наименьшей степени склонны к самоизлечению, поэтому при назначении АБТ особое внимание следует уделять активности антибиотика в отношении S. pneumoniae [6, 7].
Принципы выбора антимикробных препаратов при респираторных инфекциях
Выбор антимикробных препаратов (АМП) для лечения ИДП должен быть основан на знании природной активности антибиотиков в отношении основных респираторных возбудителей, эпидемиологических данных по антибиотикорезистентности (АБР) микроорганизмов в определенном регионе с учетом фармакокинетических (ФК) и фармакодинамических (ФД) характеристик АМП, риска развития нежелательных лекарственных реакций (НЛР), а также затрат на проведение терапии. Кроме того, в современных условиях при назначении АБТ следует обращать внимание не только на возможные неблагоприятные результаты применения антибиотика у отдельного пациента, но и на глобальные экологические последствия широкого применения различных классов АМП, а именно – на вероятность появления и распространения АБР.
Общеизвестно, что применение АМП служит основным фактором риска селекции резистентных штаммов микроорганизмов. В ряде исследований было убедительно показано, что уровень резистентности пневмококков к пенициллину в определенной степени зависит от потребления пенициллинов или β-лактамов в целом [8–10], а уровень резистентности к макролидам – от потребления макролидов [8]. При этом несомненный практический интерес для определения политики применения антибиотиков представляют работы, свидетельствующие о неравноценном потенциале различных АМП приводить к селекции резистентных штаммов. В исследованиях, организованных НИИ антимикробной химиотерапии (НИИАХ) Смоленской государственной медицинской академии в 12 детских домах 5 городов РФ, было продемонстрировано, что увеличение частоты назначения амоксициллина/клавуланата (АМК) в 2,4 раза не привело к росту резистентности назофарингеальных изолятов S. pneumoniae к пенициллину и амоксициллину, в то время как повышение потребления цефалоспоринов вызвало увеличение доли пневмококков, не чувствительных к данному классу АМП [11].
Кроме того, риск селекции резистентных штаммов возрастает при использовании субоптимальных доз АМП, недостаточных для надежной эрадикации возбудителя. Соответственно, для обеспечения максимальной “экологической” безопасности терапии необходимо использовать высокоэффективные АМП в довольно высоких дозах. Именно такой подход соответствует принципу “убитые бактерии не мутируют” [12].
Проблемы АбР респираторных возбудителей
Если сравнить данные по АБР респираторных возбудителей, полученные в ходе многоцентровых исследований ПеГАС в РФ [1, 13], и аналогичные показатели других стран мира, то на первый взгляд ситуация в России выглядит вполне благополучно. Так, по результатам исследования ПеГАС-III [1, 6] частота пенициллинорезистентности среди пневмококков в РФ составляет 11,2 % (из них 9,1 % – штаммы с промежуточной резистентностью и 2,1 % – с высоким уровнем резистентности к пенициллину).
Резистентность S. pneumoniae к эритромицину составляет менее 5 %; 99,6 и 100 % изолятов соответственно чувствительны к амоксициллину и респираторным фторхинолонам. Однако не может вызывать тревоги тот факт, что в некоторых федеральных округах РФ (Южном, Дальневосточном и Уральском) частота выделения пенициллонечувствительных пневмококков (ПНЧП) выше среднего показателя по РФ и составляет 14,3, 25 и 16,7 % соответственно [6].
В целом показатели резистентности пневмококков к пенициллину в России при сравнении со странами Европейского сообщества аналогичны таковым в Финляндии; существенно ниже, чем в Болгарии (37 %), Франции (26,8 %), Польше (29,8 %) и Испании (22 %), однако минимум вдвое выше, чем в Германии, Великобритании, Бельгии, Нидерландах, Дании, Швеции и Норвегии, где частота ПНЧП не превышает 5 % [14].
По данным глобального эпидемиологического исследования PROTECT, в 2003–2004 гг. нечувствительность к пенициллину была отмечена у 35,7 %, а к макролидам – у 36,0 % клинических штаммов S. pneumoniae; продукция β-лактамаз – у 12,3 % H. influenzae, еще 5,2 % изолятов гемофильной палочки были устойчивы к ампициллину за счет других механизмов резистентности [15].
По данным исследования ПеГАС-II, штаммы гемофильной палочки, продуцирующие β-лактамазы, в РФ не распространены и составляют 5,4 % среди всех изолятов в общей популяции [13]. В то же время можно предполагать, что у пациентов, ранее получавших АМП, частота выделения ПНЧП и ампициллинорезистентных штаммов H. influenzae окажется существенно выше, что обязательно следует учитывать при назначении терапии.
АМП для лечения респираторных инфекций в амбулаторной практике
В настоящее время в амбулаторной практике для лечения респираторных инфекций широко применяются два основных класса АМП – β-лактамы и макролиды. В последние годы отмечается относительное увеличение частоты назначений респираторных фторхинолонов (левофлоксацина). В то же время в РФ имеют место нерациональные назначения АМП для лечения респираторных инфекций в амбулаторной практике, а именно: терапияпарентеральными препаратами, назначение цефалоспоринов I–III поколений, ципрофлоксацина, ампициллина внутрь, линкозамидов при лечении нетяжелой ВП или ОБРС [1, 16].
Основное место в лечении респираторных инфекций в амбулаторной практике принадлежит амоксициллину, что обусловлено его мощным бактерицидным действием в отношении S. pneumoniae (включая штаммы со сниженной чувствительностью к пенициллину), низкой токсичностью, многолетним опытом эффективного и безопасного применения. У пациентов с факторами риска β-лактамазопродуцирующих штаммов (предшествующей АБТ, рецидивирующими или хроническими инфекциями) амоксициллин применяют в комбинации с ингибитором β-лактамаз клавуланатом в форме АМК. Амоксициллин и АМК при применении в высоких дозах (80–90 мг/кг/сут по амоксициллину) сохраняют активность в отношении пенициллинорезистентных пневмококков (ПРП).
Респираторные фторхинолоны (левофлоксацин, моксифлоксацин и гемифлоксацин) являются высокоэффективными препаратами для лечения респираторных инфекций. В то же время с позиций рационального применения АМП респираторные фторхинолоны не должны использоваться амбулаторно как препараты выбора для лечения нетяжелых инфекций у пациентов без факторов риска терапевтической неудачи [1]. “Классические” фторхинолоны (ципрофлоксацин) обладают недостаточной активностью в отношении S. pneumoniae и не должны назначаться для эмпирической терапии респираторных инфекций.
Возможности оптимизации терапии респираторных инфекций
аминопенициллинами
Принимая во внимание значение амоксициллина и АМК при лечении респираторных инфекций в амбулаторной практике, важно максимально полно использовать и сохранять терапевтический потенциал этих АМП. Для достижения этой цели следует на практике учитывать и использовать возможности оптимизации АБТ на основании знания взаимосвязи ФК- и ФД-свойств АМП. Применение ФК/ФД-принципов на практике позволяет улучшить исходы лечения пациентов с инфекциями и потенциально снизить риск АБР.
Установлено, что эффективность лечения β-лактамными антибиотиками зависит от времени поддержания концентрации препарата в очаге инфекции выше значения его минимальной подавляющей концентрации (МПК) в отношении возбудителя. Данный параметр обозначается как Т > МПК (рис. 1). Следует отметить, что приувеличении концентрации препарата более 4–5 МПК эффективность терапии не повышается, но может отмечаться возрастание риска НЛР [17]. Оптимальная эффективность терапии β-лактамами может быть достигнута при Т > МПК, составляющем минимум 40 %-ный интервал дозирования.
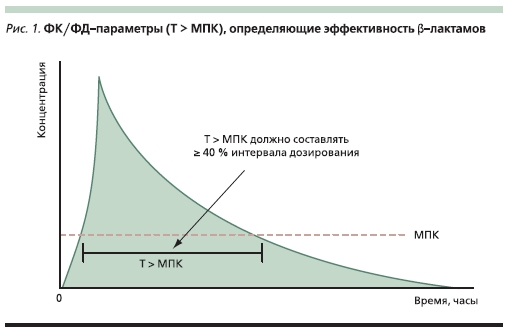
Для достижения этой цели теоретически можно использовать три способа:
1. повысить дозу препарата;
2. увеличить кратность приема АМП;
3. использовать особые лекарственные формы с модифицированным высвобождением антибиотика.
1. повысить дозу препарата;
2. увеличить кратность приема АМП;
3. использовать особые лекарственные формы с модифицированным высвобождением антибиотика.
Однако необходимо учитывать, что повышение дозы препарата вдвое не обеспечивает эквивалентного увеличения показателя Т > МПК и, соответственно, не позволяет существенно повысить эффективность терапии в случае резистентных возбудителей. Увеличение кратности введения препарата до 3–4 раз в сутки сопровождается снижением приверженности пациентов лечению. Так, было показано, что при приеме препарата 2 раза в сутки пациенты соблюдают назначенный режим лечения в 80 % случаев, а при 3-кратном приеме – только в половине [18], что несомненно отражается на эффективности терапии. Таким образом, достижение оптимальных ФК/ФД-параметров пероральных β-лактамов возможно только при использовании особых лекарственных форм с модифицированным высвобождением активного вещества.
Эволюция аминопенициллинов при лечении ИДП
История разработки новых АМП в значительной степени определяется появлением и распространением АБР у бактерий. Типичным примером, подтверждающим данный тезис, является история применения аминопенициллинов в лечении ИДП. Ампициллин был внедрен в клиническую практику в 1963 г., и понадобилось еще 10 лет для создания амоксициллина – аминопенициллина с высокой биодоступностью при приеме внутрь и максимальной среди всех пероральных β-лактамов активностью в отношении S. pneumoniae [19]. Однако уже в 1974 г. были обнаружены первые штаммы H. influenzae, резистентные к аминопенициллинам, а в 1977 г. описаны первые штаммы ПРП и M. catarrhalis, проду-
цирующие β-лактамазы. Клавулановая кислота была открыта примерно в то же время (1976), однако комбинированный препарат АМК был зарегистрирован только в 1984 г. [19].
цирующие β-лактамазы. Клавулановая кислота была открыта примерно в то же время (1976), однако комбинированный препарат АМК был зарегистрирован только в 1984 г. [19].
Таблица 2. Лекарственные формы АМК для приема внутрь [20].
Таблица 3. ФД/ФК-параметры (Т > МПК, %) пероральных β-лактамов в отношении респираторных возбудителей [21, 22 с изменениями].
Появление АМК (первоначально в форме таблеток по 625 мг, содержащих 500 мг амоксициллина и 125 мг клавуланата) позволило решить проблему терапии респираторных инфекций у взрослых, кроме случаев, вызванных пневмококками со сниженной чувствительностью к пенициллину. Поэтому дальнейшая разработка пероральных лекарственных форм АМК была направлена на повышение содержания амоксициллина в препарате, сокращение кратности приема до 2 раз в сутки и наконец на создание формы с модифицированным высвобождением (Аугментин СР; табл. 2). Следует также подчеркнуть, что применение у взрослых пациентов таблеток АМК по 375 мг не обеспечивает адекватных ФК/ФД-параметров эффективности в отношении основных бактериальных возбудителей респираторных инфекций. ФД/ФК-параметры эффективности различных пероральных β-лактамов в отношении респираторных возбудителей приведены в табл. 3 [21, 22]. Из представленных данных следует, что при инфекциях, вызванных пенициллиночувствительными пневмококками, амоксициллин (в дозе от 1,5 г/сут), АМК и цефуроксим в рекомендованных дозах будут обеспечивать достаточную эффективность терапии. Необходимо отметить, что пероральные цефалоспорины III поколения (цефиксим и цефтибутен) существенно уступают аминопенициллинам по антипневмококковой активности – даже в отношении пенициллиночувствительных штаммов S. pneumoniae.
В отношении пневмококков с промежуточной резистентностью к пенициллину достаточную активность проявляют только амоксициллин в высокой дозе (90 мг/кг/сут) и АМК СР, “традиционные” лекарственные формы и режимы дозирования АМК (500/125 мг 3 раза/сут и 875/125 мг 2 раза/сут) обладают “пограничной” активностью в отношении таких изолятов, как S. pneumoniae. И наконец гарантированная фармакодинамическая активность в отношении ПРП отмечена только при использовании АМК СР – лекарственной формы с модифицированным высвобождением. В отличие от амоксициллина АМК также сохраняет активность в отношении штаммов H. influenzae и M. catarrhalis, продуцирующих β-лактамазы.
Таблица 4. Чувствительность респираторных возбудителей в мире к пероральным АМП на основании ФД/ФК-критериев [23].
Таким образом, на сегодняшний день в мире АМК СР – наиболее активный препарат среди всех пероральных β-лактамов в отношении основных возбудителей респираторных инфекций (табл. 4) [23]. По показателям прогнозируемой фармакодинамической эффективности при респираторных инфекциях АМК СР практически эквивалентен респираторным фторхинолонам.
АМК СР – новая лекарственная форма АМК с модифицированнымвысвобождением
АМК СР представляет собой особую лекарственную форму АМК в видедвукомпонентных таблеток, содержащих 562,5 мг амоксициллина тригидрата и 62,5 мг клавулановой кислотыв слое немедленного высвобожденияи еще 437,5 мг амоксициллина в виденатриевой соли в слое замедленного высвобождения. Таким образом, вкаждой таблетке содержится 1000 мгамоксициллина и 62,5 мг клавуланата, а суточная доза составляет 4 такиетаблетки: по 2 таблетки (2000/125 мг)2 раза в сутки [24].
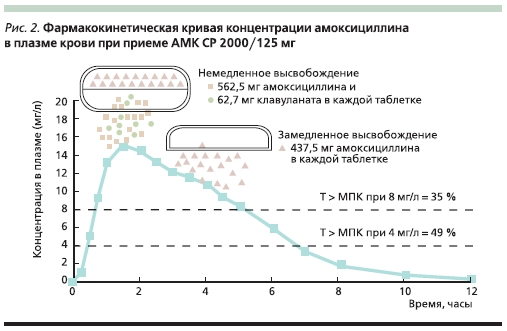
За счет такого строения таблетки и наличия слоев с немедленным изамедленным высвобождением амоксициллина пиковая концентрация действующего вещества достигается в теже сроки, что и при приеме обычногоамоксициллина или АМК. Однако засчет слоя с замедленным высвобождением концентрация амоксициллинав сыворотке крови снижается болеемедленно, чем при приеме “традиционных” препаратов, что обеспечиваетувеличение параметра Т > МПК (рис.2, 3 и 4).
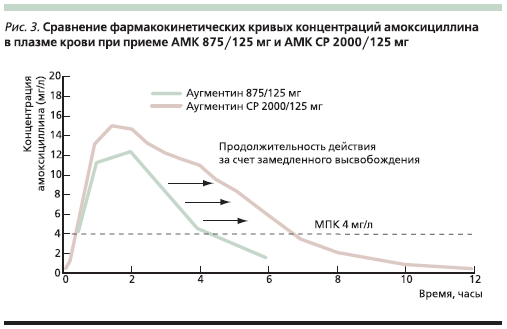
Для АМК СР по сравнению с АМК875/125 мг характерна более высокаяпиковая концентрация амоксициллина в крови (17,0 против 11,6 мг/л), аза счет более медленного ее снижения параметр T > МПК для штаммовс МПК 4 мг/л для указанных лекарственных форм АМК составляет 49 и< 35 % от интервала дозирования соответственно (рис. 3) [20].
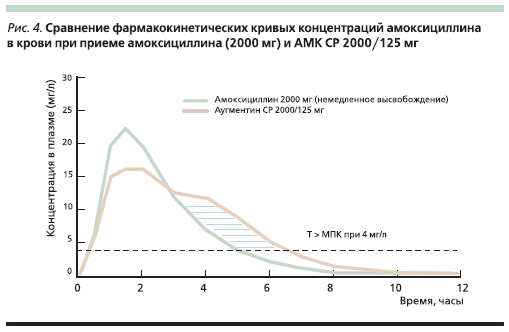
При приеме 2000 мг амоксициллина в виде обычной лекарственной формыс немедленным высвобождениемпиковая концентрация антибиотикадостигает > 20 мг/л, однако за счет еебыстрого снижения T > МПК в данномслучае меньше, чем при приеме АМКСР 2000/125 мг, и для штаммов с МПК 4 мг/л составляет 5 и 7 часов соответственно (рис. 4) [24].
Таким образом, новая лекарственная форма АМК – АМК СР – позволяет обеспечивать эффективное лечение инфекций даже при наличииПРП с МПК 4 мг/л. Помимо теоретического обоснования данный факт подтвержден результатами анализаэффективности АМК СР у пациентов с инфекциями дыхательных путей,вызванными ПРП [25]. Эрадикациявозбудителя отмечена в 96,2 % случаев респираторных инфекций, вызванныхПРП (у 51 из 53 больных). Успешнаяэрадикация возбудителя также отмечена в 14 из 15 случаев инфекций, вызванных S. pneumoniae с высокимизначениями МПК амоксициллина(4–8 мг/л) [25].
Безопасность и переносимость
АМК СР по сравнению с обычными формами АМК АМК является одним из наиболее хорошо изученных АМП в отношении профиля безопасности и переносимости, апробированного в процессе широкого клинического примененияданного препарата в мире более чем у819 млн пациентов [20].При изучении новой высокодозной лекарственной формы АМК СР оказалось, что профили ее безопасности ипереносимости существенно не отличаются от таковых традиционных лекарственных форм АМК с более низкимсодержанием амоксициллина [26–28].
В клинических исследованиях IIIфазы безопасность и переносимостьАМК СР изучены у 4144 пациентов.Частота НЛР, отмеченных при приемеАМК СР, была эквивалентной таковойпри приеме АМК 875/125 мг 2 раза всутки. Большинство НЛР были легкойстепени и транзиторными, не требовали отмены препарата и дополнительного лечения. Наиболее частыми НЛР,зарегистрированными на фоне терапииАМК СР были: диарея (15,6 %), тошнота (2,2 %), вагинальный кандидоз (2,1 %) и боль в животе (1,6 %) [22].
АМК в стандартах лечения респираторных инфекций
С учетом высокой клиническойэффективности АМК при леченииИДП данный препарат включен в национальные и международные руководства по лечению ОБС, инфекционных обострений ХОБЛ и ВП (табл. 5).
Таблица 5. АМК в национальных и международных руководствах по лечению респираторных инфекций [20 с изменениями].
В тех странах, где высокодозные лекарственные формы АМК (детская суспензия с дозировкой АМК 90/6,4 мгна 1 кг массы тела и АМК СР) зарегистрированы и применяются напрактике уже в течение почти 10 лет,отмечается замена обычных формАМК в стандартах лечения респираторных инфекций на высокодозныелекарственные формы, особенно упациентов с факторами риска наличиярезистентных возбудителей (предшествующее применение антибиотиков, сопутствующая патология, неэффективность стартовой АБТ) [29, 31, 32].
Эффективность АМК СРпри респираторныхинфекциях по данным КИ
При объединенном анализе 10 клинических исследований эффективности и безопасности АМК СР у пациентов с респираторными инфекциями (ОБС, инфекционное обострение ХОБЛ и ВП) оказалось, что общаяклиническая эффективность АМК СРпри ИДП, вызванных S. pneumoniae, всравнительных исследованиях составила 94,4 %, а в несравнительных – 94,6 %. Общая клиническая эффективность препаратов сравнения составила82,9 % [25].
Таблица 6. Результаты основных клинических исследований АМК СР при респираторных инфекциях [23, 25 с изменениями].
Результаты клинических исследований АМК СР у пациентов с ОБС(табл. 6) свидетельствуют о том, что по показателям клинической и бактериологической эффективности приданной нозологии АМК СР не уступает респираторным фторхинолонам [33,34]. Таким образом, результаты клинических исследований АМК СР приОБС полностью соответствуют прогнозируемым показателям эффективности данного препарата на основанииФК/ФД-моделирования [35].
В клиническом исследовании у пациентов с ВП АМК СР продемонстрировал по меньшей мере эквивалентнуюклиническую, рентгенологическую ибактериологическую эффективностьпо сравнению с АМК 875/125 мг, принимаемым 2 или 3 раза в сутки, и АМК1000/125 мг, принимаемым 3 раза всутки. В целом эффективность 7-дневного курса терапии АМК СР в дозе 2000/125 мг 2 раза в сутки в отношении нормализации клинических и рентгенологических симптомов ВП, а также эрадикации возбудителя составляет > 85 % [23].
В клиническом исследовании у пациентов с инфекционными обострениями ХОБЛ АМК СР обеспечивал бактериологическую эффективность терапии у 86,2 % пациентов с обострениями, предположительно вызванными H. influenzae, в то время как при лечении АМК 875/125 мг данный показатель составил только 75 % [26].
Тенденции применения АМК при респираторных инфекциях в клинической практикеДля обеспечения эффективной терапии респираторных инфекций, обусловленных ПРП, дозы амоксициллина, содержащейся в “традиционных” лекарственных формах АМК (500 или 875 мг), может быть недостаточно. При этом увеличение кратности приема таких форм, например применение АМК 875/125 мг 3 раза в сутки, не позволяет обеспечивать адекватную дозу амоксициилина (4 г/сут) и сопряжено с повышением риска НЛР (в частности, диареи), развитие которой обусловлено преимущественно клавуланатом.
В связи с этим некоторые руководства по лечению ИДП советуют назначать АМК в комбинации с амоксициллином [38] для достижения высокой эффективности терапии в отношении как ПРП, так и β-лактамазопродуцирующих штаммов H. Influenzae, а также M. catarrhalis. Появление высокодозных форм АМК, в частности АМК СР, позволило не только воплотить указанную идею, но и улучшить ФК/ФД-характеристики за счет технологии замедленного высвобождения амоксициллина.
Таким образом, появление АМК СР в клинической практике является своевременным дополнением к существующему арсеналу пероральных АМП для эффективного лечения респираторных инфекций. Оптимизация ФК/ФД-параметров, которой удалось достичь при создании АМК СР, позволила “сделать хороший антибиотик еще лучше” [39]. Использование АМК СР позволяет не только успешно лечить инфекции, вызванные возбудителями со сниженной чувствительностью к традиционным препаратам, но и надеяться на уменьшение риска селекции и распространения резистентных штаммов. Наибольшее значение новая лекарственная форма с модифицированным высвобождением имеет для терапии респираторных инфекций у пациентов с высоким риском резистентных возбудителей при наличии тяжелых сопутствующих заболеваний, таких как сахарный диабет, ХОБЛ, застойная сердечная недостаточность, новообразования и др.; ранее получавших антибиотики; у пациентов с более тяжелыми, хроническими и рецидивирующими формами инфекций. Для лечения респираторных инфекций у пациентов “без отягощенного анамнеза” в амбулаторной практике можно с успехом использовать амоксициллин в дозах от 1,5 до 4,0/сут, а также “традиционные” формы АМК (по 875/125 мг 2 раза в сутки).


